1、填空题 钡盐行业生产中排出大量的钡泥[主要含有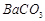 、
、 、
、 、
、 等]。某主要生产
等]。某主要生产 、
、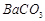 、
、 的化工厂利用钡泥制取
的化工厂利用钡泥制取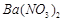 ,其部分工艺流程如下:
,其部分工艺流程如下:
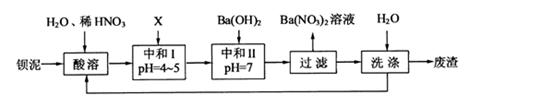
(1)酸溶后溶液中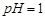 ,
, 与
与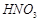 的反应化学方程式为?。
的反应化学方程式为?。
(2)酸溶时通常控制反应温度不超过70℃,且不使用浓硝酸,
原因是?、?。
(3)该厂结合本厂实际,选用的X为?(填化学式);中和Ⅰ使溶液中?(填离子符号)的浓度减少(中和Ⅰ引起的溶液体积变化可忽略)。
(4)上述流程中洗涤的目的是?。
参考答案:(1)Ba(FeO2)2+8HNO3= Ba(NO3)2+2Fe(NO3)3+4H2O
(2)防止反应速率过快;浓硝酸易挥发、分解。
(3)BaCO3 ?Fe3+、H+
(4)减少废渣中可溶性钡盐对环境的污染(凡合理答案均可)
本题解析:(1)Ba(FeO2)2与HNO3反应,生成对应的硝酸盐:Ba(FeO2)2+8HNO3= Ba(NO3)2+2Fe(NO3)3+4H2O。
(2)温度越高反应速率越快,故控制温度不超过70℃是为了防止反应速率过快,且浓硝酸越浓越易分解,温度高既易挥发,也易分解,故不用浓硝酸。
(3)X既要能中和硝酸,又不产生新杂质,结合实际,故可用BaCO3;Ⅰ中溶液含有Fe3+、H+、NO3-、Ba2+,加入BaCO3后,能使Fe3+、H+浓度减小。
(4)废渣中含有可溶性钡盐,有毒,因此,洗涤的目的是减少可溶性钡盐对环境的污染。
本题难度:一般
2、选择题 下列除杂的操作方法正确的是?(?)
A.NO中有少量的NO2:用水洗涤后再干燥
B.食盐中有少量的NH4Cl:加过量的烧碱溶液后加热蒸干
C.Cl2中有少量的HCl:通过氢氧化钠溶液洗气
D.CO2中混有少量的SO2气体:通过饱和NaHSO3溶液洗气
参考答案:A
本题解析:NO2与水反应产生NO,A正确。食盐中有少量的NH4Cl加热就可以了,烧碱过量也变成了杂质,B错误。
本题难度:一般
3、选择题 在标准状况下相同体积的下列气体,其质量最大的是
A.N2
B.SO2
C.CO2
D.CH4
参考答案:B
本题解析:分析:根据阿伏伽德罗定律的推论:相同条件下,相同体积的气体的质量和相对分子质量成正比.
解答:根据阿伏伽德罗定律的推论:相同条件下,相同体积的气体的质量和相对分子质量成正比,在标准状况下相同体积的气体中,其质量最大的就是相对分子质量最大的,四者的相对分子质量依次是:28、64、44、16,二氧化硫的最大.
故选B.
点评:本题考查学生阿伏加德罗定律的推论:相同条件下,相同体积的气体的质量和相对分子质量成正比.
本题难度:困难
4、实验题 某课外活动小组根据Mg与CO2的反应原理,探究Mg与NO2的反应及固体产物。该小组通过实验确认Mg能在NO2中燃烧,并对固体产物提出三种假设:
I.假设为:固体产物为MgO? II.假设为:______________III.假设为:______________
请回答下列问题:资料信息:2NO2+2NaOH=NaNO3+NaNO2+H2O
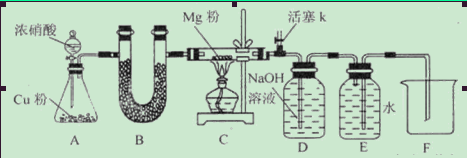
(1)如图连接好仪器,装药品前如何检验装置的气密性_____________________________
(2)装置B中盛装的干燥剂可以是(填序号)___________________
①浓硫酸?②无水CaCl2?③碱石灰?④五氧化二磷
(3)开始打开活塞k,让A中反应进行一段时间,待C中充满红综色气体后,关闭活塞k,再点燃C处酒精灯,同时D中碱液盛的很满,这样做的目的是_________________________
(4)E中收集到的气体对氢气的相对密度是14,该气体是__________________
(5)实验得到固体残留物的质量是实验前Mg粉质量的1.5倍,则假设__________________成立。C中发生的化学反应方程式有_______________________________________________
(6)本实验中存在明显缺陷,改进措施是_______________________________________。
参考答案:Ⅱ.固体产物为Mg3N2?Ⅲ.固体产物为MgO和Mg3N2?(1)关闭分液漏斗活塞和活塞K,将导气管末端插入水中,对锥形瓶(或C处反应管)微热,若导气管口有气泡,停止加热,导气管中进入一段水柱,表示气密性良好。 (2)②④ (3)排净装置中空气,防止空气干扰实验。
(4)N2 (5)假设Ⅲ? 4Mg+2NO2 4MgO+N2? 3Mg+N2
4MgO+N2? 3Mg+N2 Mg3N2
Mg3N2
(6)活塞K处的导气管插入NaOH溶液中,进行尾气吸收。
本题解析:在NO2中含有N、O元素,所以Mg在其中燃烧产物可能是MgO、Mg3N2或它们的混合物。假设Ⅱ.固体产物为Mg3N2?。Ⅲ.固体产物为MgO和Mg3N2(1)如图连接好仪器,装药品前装置的气密性检验方法是:关闭分液漏斗活塞和活塞K,将导气管末端插入水中,对锥形瓶(或C处反应管)微热,若导气管口有气泡,停止加热,导气管中进入一段水柱,表示气密性良好。(2)Cu与浓硝酸反应产生的气体NO2是酸性气体,不能使用碱性干燥剂来干燥。排除?③碱石灰;U形管装的是固体干燥剂,而浓硫酸是液体,不能使用,排除①浓硫酸。故装置B中盛装的干燥剂可以是②无水CaCl2 ④五氧化二磷。(3)开始打开活塞k,让A中反应进行一段时间,待C中充满红综色气体后,关闭活塞k,再点燃C处酒精灯,同时D中碱液盛的很满,这样做的目的是排净装置中空气,防止空气干扰实验。(4)E中收集到的气体对氢气的相对密度是14,相对分子质量为14×2=28,该气体是N2.(5)若完全转化为MgO,则反应后的固体质量是反应前的(24+16):24=1.67倍.若完全转化为Mg3N2,则反应后的固体质量是反应前的(24×3+14×2):(24×3)=1.39倍。实验得到固体残留物的质量是实验前Mg粉质量的1.5倍,所以得到的是MgO和Mg3N2的混合物。故假设设Ⅲ成立。C中发生的化学反应方程式有4Mg+2NO2 4MgO+N2? 3Mg+N2
4MgO+N2? 3Mg+N2 Mg3N2。(6)本实验中存在明显缺陷,就是没有尾气处理装置。改进措施是活塞K处的导气管插入NaOH溶液中,进行尾气吸收。2的反应及固体产物的成分。
Mg3N2。(6)本实验中存在明显缺陷,就是没有尾气处理装置。改进措施是活塞K处的导气管插入NaOH溶液中,进行尾气吸收。2的反应及固体产物的成分。
本题难度:困难
5、选择题 下列说法中不正确的是
A.Na2CO3比NaHCO3易溶于水
B.Na2CO3?和NaHCO3均可与HCl反应
C.Na2CO3的稳定性比NaHCO3强
D.Na2CO3能与石灰水反应而NaHCO3不反应
参考答案:D
本题解析:分析:A.Na2CO3比NaHCO3溶解度大;
B.碳酸盐和碳酸氢盐都能与盐酸反应;
C.NaHCO3具有热不稳定性;
D.石灰水也能与NaHCO3反应生成碳酸钙沉淀.
解答:A.Na2CO3比NaHCO3溶解度大,易溶于水,故A正确;
B.Na2CO3?和NaHCO3均可与HCl反应生成二氧化碳和水,故B正确;
C.NaHCO3具有热不稳定性,加热易分解,而碳酸钠难分解,故C正确;
D.石灰水也能与NaHCO3反应:当石灰水少量时,Ca(OH)2+2NaHCO3=CaCO3↓+Na2CO3+2H2O,当石灰水足量时,Ca(OH)2+NaHCO3=CaCO3↓+NaOH+H2O,故D错误.
故选D.
点评:本题考查Na2CO3和NaHCO3性质的异同,题目难度不大,注意把握Na2CO3和NaHCO3性质,注重基础知识的积累.
本题难度:一般