| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点总结《物质的分离、提纯》高频考点巩固(2020年模拟版)(八)
(3)使用装置Ⅱ的目的是 _________________________________________________ ; (4)使用装置Ⅲ的目的是___________________________________________________; (5)确证含有乙烯的现象是_________________________________________________。 参考答案:(1)ABAD; ?(2) (1)中品红褪色;?(3)除去二氧化硫;? 本题解析:乙烯和二氧化硫都能使溴水褪色,也都能使酸性高锰酸钾溶液褪色。所以在检验乙烯前要先检验二氧化硫并将其除去。SO2有漂白性,能使品红溶液褪色。用品红来检验SO2的存在。SO2是酸性氧化物,能和碱发生反应生成盐和水。用氢氧化钠溶液除去二氧化硫。二氧化硫是否除干净再用品红来检验。最后用酸性高锰酸钾溶液来验证乙烯的存在。 本题难度:一般 4、选择题 可以用分液漏斗进行分离的混合物是 [? ] A.酒精和碘水 参考答案:B 本题解析: 本题难度:简单 5、实验题 Ⅰ.(1)某兴趣小组甲设计了以下装置和方法测定空气中SO2含量。你认为可行的操作是?(填序号)
(2)兴趣小组乙取336mL(标准状况)某由SO2和N2组成的混合气体Y,将其通入足量溴水中,然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33g。由此推知气体Y中SO2的体积分数为?。 Ⅱ某化学兴趣小组丙为探究Fe3+是否能氧化SO2,设计了如下实验装置。 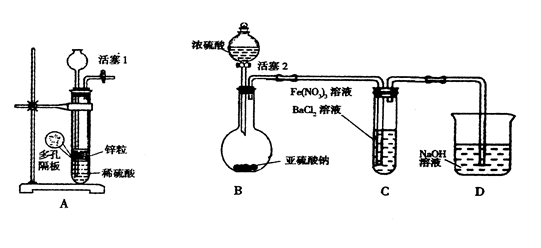 (1)如上图连接好装置。实验前应进行?操作? (2)观察到装置C中产生了白色沉淀,同学们提出了以下猜想(每个猜想只考虑一种物质的氧化性)。 猜想1:?; 猜想2:SO2被Fe3+氧化了;? 猜想3:SO2被NO3—氧化了 (3)甲同学认为猜想1正确,并利用上述装置A进行了排除干扰的探究实验。 (4)乙同学认为猜想2正确,则装置C中反应的离子方程式是? (5)丙同学认为猜想3正确,他利用甲同学的实验装置,设计实验验证猜想。请在答题卡上写出实验步骤以及预期现象和结论。限选实验试剂:NaNO3溶液、KSCN溶液、FeCl3溶液、BaCl2溶液、
Fe(NO3)3溶液 参考答案:Ⅰ(1)B?(2)66.7% 本题解析:Ⅰ.(1)A中通入二氧化硫气体不会生成沉淀,故错误。B中二氧化硫和高锰酸钾反应生成了硫酸根,紫色褪色,可以检测,正确;空气中含有二氧化碳也会与碱石灰反应,错误;(2)兴趣小组乙取336mL(标准状况)某由SO2和N2组成的混合气体Y,将其通入足量溴水中,然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33g。由此推知气体Y中SO2的体积分数为SO2具有还原性,通入足量溴水中,发生SO2+Br2+2H2O=2HBr+H2SO4,离子方程式的书写,将产物中的氢溴酸和硫酸拆成离子,所以离子方程式为SO2+Br2+2H2O═2Br-+SO42-+4H+,生成的硫酸遇到氯化钡会产生白色沉淀,可以先洗涤然后再过滤来获得纯净的硫酸钡沉淀,则n(混合气体)=0.336L/22.4=0.015mol, 本题难度:困难 | |||||||||||||||||||||||||||||||||||||||
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学必考知识点《无机综合与.. | |