1、选择题 表中原子化热、晶格能、键能的单位都是kJ·mol-1
A.Na(s)与Cl2(g)反应生成1molNaCl(s)放出的热量为556.1kJ
B.Si(s)+2Cl2(g)=SiCl4(g)?△H=-602kJ·mol-1
C.从表中可以看出,氯化钠的熔点比晶体硅高
D.从表中数据可以看出,微粒半径越大金属键、离子键的越弱,而共价键却越强
参考答案:B
本题解析:试题分析:金属原子化热是指 1mol 金属变成气态原子所需要的热量,不能用金属原子化热计算Na(s)与Cl2(g)反应生成1molNaCl(s)放出的热量,A项错误;氯化钠与晶体硅的晶体类型不同,所以不能用晶格能和共价键的键能来比较,C项错误;微粒半径越大,共价键也越弱,D项错误;C项:△H="176" kJ·mol-1X2+2X243 kJ·mol-1-360 kJ·mol-1X4="-602" kJ·mol-1,B项正确。
考点:本题考查△H的计算及化学键的强弱、晶体熔点的比较。
本题难度:一般
2、选择题 短周期元素A、B、C、D的原子序数依次递增,它们的原子序数之和为32,且原子最外层电子数之和为10;A、C原子的最外层电子数之和等于B原子的次外层电子数;A与C,B与D均为同主族元素。下列叙述正确的是
A.四种元素的原子半径:AB.最高价氧化物对应的水化物的酸性:B>D
C.C元素处于元素周期表中第3周期第ⅡA族
D.B、D的最高价氧化物中,B、D与氧原子之间均为单键
参考答案:B
本题解析:A与C,B与D均为同主族元素,A、B、C、D属于短周期且原子序数依次递增,所以B属于第二周期,次外层含有2个电子。A、C原子的最外层电子数之和等于B原子的次外层电子数,所以A、C属于IA元素,C是钠元素。又因为四种元素的原子最外层电子数之和为10,属于BD属于ⅣA元素,分别是C和Si。根据四种元素的原子序数之和为32可得出A的原子序数是1,即为氢元素。四种元素的原子半径为A<B<D<C,二氧化碳中含有碳氧双键,所以正确的答案是B。
本题难度:困难
3、选择题 金属晶体具有延展性的原因
A.金属键很微弱
B.金属键没有饱和性
C.密堆积层的阳离子容易发生滑动,但不会破坏密堆积的排列方式,也不会破坏金属键
D.金属阳离子之间存在斥力
参考答案:C
本题解析:试题分析:金属晶体是由金属阳离子和自由电子构成的,二者之间存在金属键。当金属受到外力作用时,密堆积层的阳离子容易发生相对滑动,但不会破坏密堆积的排列方式,也不会破坏金属键,所以金属晶体具有延展性,答案选C。
考点:考查金属晶体的性质和结构特点
点评:本题是常识性知识的考查,难度不大。主要是检验学生对基础知识的理解掌握程度,和灵活运用知识的能力。
本题难度:一般
4、选择题 下列物质中,以极性键结合的是
A.MgO
B.NaCl
C.H2
D.H2O
参考答案:D
本题解析:
本题难度:简单
5、选择题 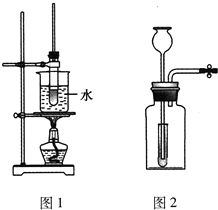 下列有关实验原理或操作正确的是
下列有关实验原理或操作正确的是
A.配制0.1?mol/L烧碱溶液时,容量瓶应先用0.1?mol/L烧碱溶液润洗
B.不用其他试剂即能鉴别出Al2(SO4)3、KOH、HCl、KCl四种溶液
C.实验室可用如图1所示的装置制备乙酸丁酯(已知乙酸丁酯的沸点为124~126℃,反应温度为115~125℃)
D.实验室用如图2所示的装置制备氢气时,该装置符合“随开随制、随关随停”的要求
参考答案:B
本题解析:分析:A.容量瓶不能用待测液润洗;
B.根据Al2(SO4)3与KOH相互滴加,顺序不同现象不同进行检验;
C.不能用水浴加热;
D.小试管只起到液封的作用,不能“随开随制、随关随停”.
解答:A.配制一定物质的量浓度的溶液时,容量瓶无需干燥、无需润洗,故A错误;
B.Al2(SO4)3与KOH相互滴加,顺序不同现象不同,生成的Al(OH)3可溶于盐酸,可鉴别,故B正确;
C.实验温度为115~125℃,不能用水浴加热,故C错误;
D.实验装置不符合“随开随制、随关随停”的要求,小试管只起到液封的作用,故D错误.
故选B.
点评:本题考查化学实验方案的评价,题目侧重于物质的检验、制备等实验基本操作的考查,题目难度不大,注意相关基础知识的学习.
本题难度:困难