| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学试题《化学反应与能量》高频考点强化练习(2020年最新版)(六)
参考答案:C 本题解析:C的燃烧反应为放热反应,A错;书写热化学方程式需要带状态,B错;ΔH的单位为kJ·mol-1,D错。 本题难度:一般 3、计算题 已知2H2(g)+O2(g) 参考答案:3∶1 本题解析:本题主要考查根据燃烧热计算反应物的组成。可以用三种解题方法解答本题:估算法,十字交叉法和列方程组求解法。 本题难度:一般 4、选择题 当压力达到220 atm、温度达到374 ℃时,水成为“超临界状态”,此时水可将CO2等含碳化合物转化为有机物,这就是“水热反应”,生物质在地下高温高压条件下通过水热反应可生成石油、煤等矿物能源。下列说法不正确的是( ) |
参考答案:
本题解析:
本题难度:一般
5、选择题 下列图示与对应的叙述相符的是
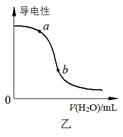
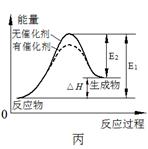
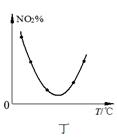
A.图甲表示向CH3COOH溶液中逐步加入CH3COONa固体后,溶液pH的变化
B.图乙表示向CH3COOH溶液中加水时溶液的导电性变化,则CH3COOH溶液的pH:a>b
C.图丙表示催化剂能改变化学反应的焓变
D.图丁表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应:2NO2(g) N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0
N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0
参考答案:D
本题解析:A、向CH3COOH溶液中逐步加入CH3COONa固体抑制醋酸的电离,溶液的pH增大,A错误;B、醋酸溶液的导电性越强,氢离子浓度越大,pH越小,则CH3COOH溶液的pHa<b,B错误;C、催化剂能改变活化能,当不能改变焓变,C错误;D、NO2含量到达最低时继续升高温度反而升高,这说明升高温度平衡向正反应方向移动,所以该反应的△H<0,即为放热反应,D正确,答案选D。
考点:考查弱电解质的电离、溶液导电性、焓变以及反应热判断等
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点归纳《化学平衡》.. | |