1、选择题 如下图所示,△H1=-393.5 kJ/mol,△H2=-395.4 kJ/mol,下列说法或表示式正确的是
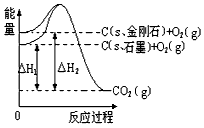
[? ]
A.C(s、石墨)== C(s、金刚石) △H= +1.9 kJ/mol
B.石墨和金刚石的转化是物理变化
C.金刚石的稳定性强于石墨
D.1 mol石墨的总键能比1 mol金刚石的总键能小1.9 kJ
参考答案:A
本题解析:
本题难度:一般
2、选择题 在298K、100kPa时,已知:
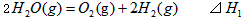
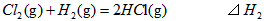
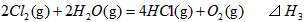
则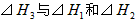 间的关系正确的是
间的关系正确的是
[? ]
A.
B.
C.
D.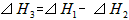 ?
?
参考答案:A
本题解析:
本题难度:一般
3、简答题 火力发电厂释放出大量的氮氧化物(NOx)、二氧化硫和二氧化碳等气体会造成环境污染.对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的.
(1)脱硝.利用甲烷催化还原NOx:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ?mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=-1160kJ?mol-1
甲烷直接将NO2还原为N2的热化学方程式为______.
(2)脱碳.将CO2转化为甲醇的热化学方程式为:CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H3
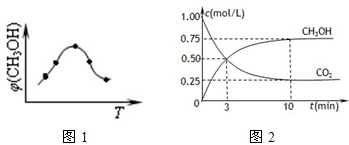
①取五份等体积的CO2和H2的混合气体(物质的量之比均为1:3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)?与反应温度T的关系曲线如图1所示,则上述CO2转化为甲醇的反应的△H3______0(填“>”、“<”或“=”).
②在一恒温恒容密闭容器中充入1mol?CO2和3mol?H2,进行上述反应.测得CO2和CH3OH(g)的浓度随时间变化如图2所示.试回答:0~10min内,氢气的平均反应速率为______mol/(L?min);该温度下,反应的平衡常数的值为______;第10min后,向该容器中再充入1mol?CO2和3mol?H2,则再次达到平衡时CH3OH(g)的体积分数______(填变大、减少、不变).
(3)脱硫.某种脱硫工艺中将废气经处理后,与一定量的氨气、空气反应,生成硫酸铵和硝酸铵的混合物作为副产品化肥.硫酸铵和硝酸铵的水溶液的pH<7,其原因用离子方程式表示为______;在一定物质的量浓度的硝酸铵溶液中滴加适量的NaOH溶液,使溶液的pH=7,则溶液中c(Na+)+c(H+)______c(NO3-)+c(OH-)(填写“>”“=”或“<”)
参考答案:(1)已知:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ?mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=-1160kJ?mol-1
则CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=12(-574kJ?mol-1-1160kJ?mol-1)=-867?kJ/mol
故答案为:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867?kJ/mol;
(2)①根据图是内容知道:温度升高,甲醇的体积分数φ(CH3OH)减小,平衡逆向移动,所以反应是放热的,即△H<0,故答案为:<;
?②0~10min内,二氧化碳的平均反应速率=1.0mol/L-0.25mol/L10min=0.075mol/(L?min),所以氢气的反应速率是3×0.075mol/(L?min)=0.225mol/(L?min),
? CO2(g)+3H2(g)═CH3OH(g)+H2O(g)
初始浓度:1? 3? 0?0
变化浓度:0.75? 2.25? 0.75? 0.75
平衡浓度:0.25? 0.75? 0.75? 0.75
所以平衡常数K=0.7520.25×0.753=163
向该容器中再充入1mol?CO2和3mol?H2,会使得压强增大,平衡正向移动,所以则再次达到平衡时CH3OH(g)的体积分数变大,故答案为:0.225;163;变大;
(3)硫酸铵和硝酸铵的水溶液的pH<7,其原因是溶液中铵根离子水解显示酸性,即NH4++H2O═NH3?H2O+H+,硝酸铵溶液中滴加适量的NaOH溶液,使溶液的pH=7,则溶液中c(Na+)+c(H+)+c(NH4+)=c(NO3-)+c(OH-),所以c(Na+)+c(H+)<c(NO3-)+c(OH-),故答案为:<.
本题解析:
本题难度:一般
4、填空题 研究NO2、SO2、等大气污染气体的处理具有重要意义.
(1)NO2可用水吸收,相应的化学反应方程式为______.利用反应6NO2+8NH3
7N2+12H2O也可处理NO2.当转移1.2mol电子时,消耗的NO2在标准状况下是______L.
(2)已知:2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ?mol-1
2NO(g)+O2(g)?2NO2(g)△H=-113.0kJ?mol-1
则反应NO2(g)+SO2(g)?SO3(g)+NO(g)的△H=______kJ?mol-1.
一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是______.
a.体系压强保持不变b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变d.每消耗1molSO3的同时生成1molNO2
测得上述反应平衡时NO2与SO2体积比为1:6,则平衡常数K=______.
参考答案:(1)NO2与H2O反应的方程式为:3NO2+H2O═2HNO3+NO;6NO2+8NH3═7N2+12H2O,当反应中有1 mol NO2参加反应时,共转移了4 mol电子,故转移1.2mol电子时,消耗的NO2为1.2×14×22.4L=6.72L,故答案为:3NO2+H2O=NO+2HNO3;6.72;
(2)根据盖斯定律,将第二个方程式颠倒过来,与第一个方程式相加得:2NO2+2SO2═2SO3+2NO,△H=-83.6 kJ?mol-1,则NO2+SO2?SO3+NO,△H=-41.8 kJ?mol-1;
本反应是反应前后气体分子数不变的反应,故体系的压强保持不变,故a不能说明反应已达到平衡状态;随着反应的进行,NO2的浓度减小,颜色变浅,故b可以说明反应已达平衡;SO3和NO都是生成物,比例保持1:1,故c不能作为平衡状态的判断依据;d中所述的两个速率都是逆反应速率,不能作为平衡状态的判断依据,故选c;
NO2(g)+SO2(g) SO3(g)+NO(g)
SO3(g)+NO(g)
起始物质的体积 1a 2a 0 0
转化物质的体积 x x x x
平衡物质的体积 1a-x 2a-xxx
则(1a-x):(2a-x)=1:6,故x=45a,故平衡常数为=x2/(1a-x)(2a-x)=83.
故答案为:-41.8;b;83.
本题解析:
本题难度:简单
5、填空题 氨在国民经济中占有重要的地位.
(1)生成氢气:将水蒸气通过红热的炭即产生水煤气.
C(s)+H2O(g)?H2(g)+CO(g);△H=+131.3kJ/mol;△S=+133.7J/(mol?K).该反应在较低温度下能否自发进行______(填“能”或“不能”)
(2)已知在400°C时,2NH3(g)?N2(g)+3H2(g);△H>0的K=2.
①400°C时,N2(g)+3H2(g)?2NH3(g)的K=______(填数值)
②400°C时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时v(NH3)正______v(NH3)逆(填“大于”、“小于”、“等于”、“不确定”)
(3)体积相同的甲、乙两个容器中,分别充入等物质的量的氮气和氢气,在相同温度下发生反应N2(g)+3H2(g)?2NH3(g)并达到平衡,在这一过程中,甲容器保持体积不变,乙容器保持压强不变,则甲容器中氮气的转化率______乙容器中氮气的转化率(填“大于”、“小于”或“等于”)
(4)已知:1/2N2(g)+3/2H2(g)=NH3(g);△H=-46.0kJ/mol
H2(g)+1/2O2(g)=H2O(l);△H=-285.8kJ/mol
1/2N2(g)+O2(g)=NO2(g);△H=+33.9kJ/mol
H2O(l)=H2Og);△H=+44kJ/mol则氨气燃烧热的热化学方程式为______.
参考答案:(1)为使反应能自发进行,则有△G=△H-T?△S=+131.3kJ/mol-T×10-3×(+133.7kJ/(mol?K))<0,
T>131.3×103133.7=982K,在较低温度下不能自发进行,故答案为:不能;
(2)①由题意可知:K1=c(N2)?c3(H2)c2(NH3)=2,则K2=c2(NH3)c(N2)c3(H2)=0.5,故答案为:0.5;?
②一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,
则c(N2)=4mol/L,c(H2)=2mol/L,c(NH3)=4mol/L,
则K2=c2(NH3)c(N2)c3(H2)=424×23=0.5,说明反应达到平衡状态,则有v(NH3)正=v(NH3)逆,
故答案为:等于;
(3)甲容器保持体积不变,乙容器保持压强不变,随着反应的进行,甲容器中的压强逐渐减小,因增大压强平衡向正反应方向移动,
则甲容器中氮气的转化率小于乙容器中氮气的转化率,故答案为:小于;
(4)已知:①12N2(g)+32H2(g)=NH3(g)△H=-46.0kJ/mol;
②H2(g)+12O2(g)=H2O(l)△H=-285.8kJ/mol;
③12N2(g)+O2(g)=NO2(g)△H=+33.9kJ/mol;
④H2O(l)=H2O(g)△H=+44kJ/mol;
由盖斯定律可知,将②×32+③-①可得NH3(g)+74O2(g)=NO2(g)+32H2O(l),
其反应热△H=(=-285.8kJ/mol)×32+(+33.9kJ/mol)-(-46.0kJ/mol)=-348.8kJ/mol,
则氨气燃烧热的热化学方程式为:NH3(g)+74O2(g)=NO2(g)+32H2O(l)△H=-348.8kJ/mol,
故答案为:NH3(g)+74O2(g)=NO2(g)+32H2O(l)△H=-348.8kJ/mol.
本题解析:
本题难度:简单