| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学必考知识点《物质的量》试题特训(2020年最新版)(四)
参考答案:A 本题解析:A、氯气在反应中不一定全部是氧化剂,所以1 mol Cl2在反应中得到电子数不一定为2NA,A正确;B、氧气在反应中不一定得到4个电子,也可能得到2个电子,所以1 mol O2在反应中得到电子数不一定为4 NA,B不正确;C、过氧化钠再与水的反应中氧元素的化合价部分降低到-2价,部分升高到0价,即过氧化钠既是氧化剂,也是还原剂,则1 mo1 Na2O2与足量H2O反应,转移了 NA个电子,C错误;D、在2KClO3+4HC1(浓)==2KCl+2C1O2↑+C12↑+2H2O中,氯气只是氧化产物,C1O2是还原产物,D错误,答案选A。 本题难度:一般 3、选择题 设NA为阿伏伽德罗常数的值。下列说法正确的是 |
参考答案:D
本题解析:A.在过氧化钠与水发生歧化反应中,每生成0.1mol氧气,转移电子的数目为0.2NA,故A错误。B.丙烯酸分子中含有1个碳碳双键1个碳氧双键,所以0.1mol丙烯酸中含有双键的数目为0.2NA,故B错误。C.标准状况下,苯为液体,故C错误。D.氧气和臭氧均为氧元素的单质,所以1.6g由氧气和臭氧组成的混合物中含有氧原子的数目为1.6g÷16g.mol-1×NA=0.1NA,故D正确。
考点:了解阿佛加德常数的含义。
点评:关于阿伏加德罗常数(NA)的考查,涉及的知识面广,灵活性强,是高考命题的热点。解答该类题目时要细心审题,特别注意题目中的关键性字词,留心“陷阱”。
本题难度:一般
4、实验题 今欲用NaOH固体配制500mL 0.2mol/L的NaOH溶液。根据题意填空:
(1)配制该溶液应选用 mL容量瓶。
(2)称量时将NaOH放在__________中,用托盘天平称取 g。
(3)若实验时遇到下列情况,将会使所配的溶液浓度发生什么变化(填“偏高”、“偏低”或“无影响”):
A.加水定容时超过刻度线 ;
B.没有将洗涤液转入容量瓶中 ;
C.容量瓶内壁沾有水滴没有烘干就进行配制 ;
D.定容时俯视 ;
(4)选择下列实验方法分离物质,将分离方法的序号填在横线上
A.过滤 B.渗析 C.蒸发结晶 D.蒸馏
①______分离饱和食盐水与沙子的混合物。
②______从硝酸钾和氯化钠的混合液中获得硝酸钾。
参考答案:(9分) (1) 500 mL容量瓶 (2) 烧杯 4.0 g
(3)A.偏低 ;B.偏低 ;C.无影响 ;D.偏高 ;(4)①A ②C
本题解析:(1)用NaOH固体配制500mL 0.2mol/L的NaOH溶液,则需要500ml容量瓶。
(2)500mL 0.2mol/L的NaOH溶液中溶质的质量是0.5L×0.2mol/L×40g/mol=4.0g。由于氢氧化钠具有吸水性和腐蚀性,称量时应该放在烧杯中。
(3)根据n=c·V可知,如果加水定容时超过刻度线,则溶液的体积增加,浓度偏低;如果没有将洗涤液转入容量瓶中,则溶质减少,浓度偏低;如果容量瓶内壁沾有水滴没有烘干就进行配制,则溶质和溶液体积不影响,浓度不变;如果定容时俯视,则容量瓶中溶液的体积减少,浓度偏高。
(4)结晶法适用于不同溶质的溶解度受温度影响不同而分离的一种方法,蒸馏是依据混合物中个组分沸点不同而分离的一种法,适用于除去易挥发、难挥发或不挥发杂质,过滤适用于不溶性固体和液体之间的一种分离方法,渗析一般用于胶体的提纯和分离。沙子不溶于水,过滤即可;硝酸钾和氯化钠的溶解度受温度影响的变化程度不同,可以用结晶法得到硝酸钾。
考点:考查一定物质的量浓度溶液的配制、物质的分离和提纯
点评:该题是中等难度的试题,试题在考查基础知识的同时,侧重能力的培养的解题方法指导,有助于培养学生的逻辑思维能力。该题的难点在于误差分析,该题学生需要明确配制物质的量浓度溶液时,要注意根据cB=nB/V可得,一定物质的量浓度溶液配制的误差都是由溶质的物质的量nB和溶液的体积V引起的。误差分析时,关键要看配制过程中引起n和V怎样的变化。在配制一定物质的量浓度溶液时,若nB比理论值小,或V比理论值大时,都会使所配溶液浓度偏小;若nB比理论值大,或V比理论值小时,都会使所配溶液浓度偏大。
本题难度:一般
5、选择题 现有MgCl2和Al2(SO4)3混合溶液,向其中不断加入Na2O2,得到沉淀的量与加入Na2O2的物质的量如图所示,原溶液中Cl-与SO42-的物质的量之比为 (?)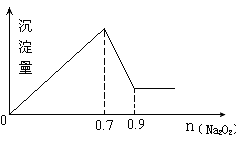
A.1:3
B.2:3
C.6:1
D.3:1
参考答案:A
本题解析:MgCl2和Al2(SO4)3都会与NaOH反应生成溶解度较低的碱性沉淀,
MgCl2 ?+? 2NaOH? =? 2NaCl? +? Mg(OH)2↓(白色不溶于水的沉淀)
Al2(SO4)3? +? 6NaOH? =? 3Na2SO4? +? 2Al(OH)3↓(白色不溶于水的沉淀)而Al(OH)3具有两性,即可溶于酸,又可溶于强碱。
Al(OH)3? +? NaOH? =? NaAlO2(偏铝酸钠)? +? 2H2O(沉淀消失)这就是为什么反应后段沉淀量会急剧下降的原因。
根据反应方程:
Al(OH)3? +? NaOH? =? NaAlO2? +? 2H2O
1-------------------1--------------1------------2
可知:NaOH用量是0.2体积,所以Al(OH)3也必然是0.2体积,
而Al全部来源于Al2(SO4)3,在Al2(SO4)3中Al:(SO4)2- ?=? 2:3,
所以可推出(SO4)2-体积必为 0.3体积沉淀达到最大量时NaOH用量是0.7体积,
又可推断出Al3+在变为Al(OH)3时又已经消耗了NaOH 0.6体积,
可推断与MgCl2反应的NaOH用量是0.1体积(0.7-0.6),
MgCl2? +? 2NaOH? =? 2NaCl? +? Mg(OH)2↓,
1? 2? 2? 1
0.05? 0.1
而在MgCl2中,Mg:Cl = 1:2
所以Cl用量必为 0.1体积。
所以Cl- :(SO4)2- = 0.1体积:0.3体积 = 1:3。故选择 A。
点评:本题考查的是化学的基本计算,发生的反应都源自于教材内容,因此熟悉常见无机物之间的反应是解决此类问题的关键。
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点总结《盖斯定律》.. | |