|
高考化学必考知识点《物质的量》试题特训(2020年最新版)(八)
2025-06-26 04:05:48
【 大 中 小】
|
1、选择题 设NA为阿伏加德罗常数,下列说法正确的是( )
A.标准状况下,0.1 molCl2溶于水,转移的电子数目为0.1NA
B.物质的量浓度为0.1mol·L-1的MgCl2溶液中,含有Cl-个数为0.2NA
C.标准状况下,2.24L甲醇中含有C—H键的数目为0.3NA
D.常温下,22gCO2和N2O混合气体中,含有的原子数目为1.5NA
|
参考答案:D
本题解析:A、0.1 mol Cl2溶于水,部分氯气与水反应,无法计算转移的电子数目,故A错误;B、缺少溶液体积,无法计算Cl-的物质的量,故B错误;C、标准状况下甲醇是液态,2.24L甲醇的物质的量不是1摩尔,含有C—H键的数目无法计算,故C错误;D、CO2和N2O的摩尔质量都是44g/mol,22g CO2和N2O混合气体的物质的量是0.5摩尔,含有的原子数目为1.5NA,故D正确.故答案选D.
考点:阿伏加德罗常数 物质的量.
本题难度:一般
2、选择题 下列溶液中Cl-浓度最大的是
[? ]
A.0.4 mol·L-1 AlCl3
B.0.8 mol·L-1 NaCl
C.0.5 mol·L-1 MgCl2
D.1.5 mol·L-1 KClO3
参考答案:A
本题解析:
本题难度:简单
3、实验题 某化学实验室需要0.2mol/L NaOH溶液500 mL和0.5 mol/L硫酸溶液450 mL。根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是?(填序号),配制上述溶液还需用到的玻璃仪器是??(填仪器名称)。
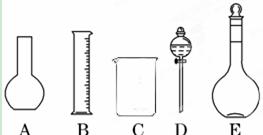
(2)容量瓶是配制溶液的主要仪器,容量瓶上标有以下六项中的___________(填写序号)。
①温度?②浓度?③容量?④压强?⑤酸式或碱式?⑥刻度线
(3)配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次)?。
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶
B.准确称取计算量的氢氧化钠固体于烧杯中,再加入少量水(约50mL),用玻璃棒慢慢搅动,使其充分溶解,冷却到室温
C.将容量瓶盖紧,摇匀?
D.将溶解的氢氧化钠溶液沿玻璃棒注入容量瓶中
E.改用胶头滴管加水,使溶液凹液面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度2~3cm处
(4)根据计算得知,所需质量分数为98%、密度为1.84 g/cm3的浓硫酸的体积为:??mL(计算结果保留一位小数)。
(5)配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是:_________________。
(6)将所配制的稀H2SO4进行测定,发现实际浓度小于0.5mol/L。请你分析下列哪些操作会引起所配浓度偏小(填写字母)?。
A.用量筒量取浓硫酸时,仰视量筒的刻度
B.容量瓶未干燥即用来配制溶液
C.浓硫酸在烧杯中稀释后,未冷却就立即转移到容量瓶中,并进行定容
D.往容量瓶转移时,有少量液体溅出
E.在容量瓶中定容时俯视容量瓶刻度线
F.烧杯未进行洗涤
G.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线。
参考答案:(1)AD?玻璃棒、胶头滴管
(2)①③⑥
(3)BDAFEC
(4)13.6mL
(5)将浓硫酸沿着烧杯壁(或玻璃棒)缓慢倒入水中,并不断用玻璃棒搅拌
(6)DFG
本题解析:(1)配制溶液时用不到平底烧瓶和烧杯,还需要玻璃棒搅拌和引流,胶头滴管定容。(2)容量瓶上标有温度,容积和刻度线。(3)配制的正确顺序是:取溶质-溶解冷却-洗涤-定容-摇匀。(4)利用稀释公式C1V1=C2V2,带入可得。(5)稀释浓硫酸时应防止大量放热,将浓硫酸沿着烧杯壁(或玻璃棒)缓慢倒入水中,并不断用玻璃棒搅拌(6)D操作溶质减少,所配浓度减少。F操作溶质减少,所配浓度减少。G操作溶液体积变大,所配溶液浓度减少。
本题难度:一般
4、选择题 NA表示阿伏加德罗常数,下列判断正确的是? ( )
A.在18 g18O2中含有2NA个氧原子
B.1 mol H2与1 mol Cl2反应生成NA个HCl分子
C.1 mol Ca变成Ca2+时失去的电子数为2NA
D.电解精炼铜时,若阴极得到电子数为2NA个,则阳极质量减少64 g
参考答案:C
本题解析:A错,18 g18O2中含有NA个氧原子;B错,1 mol H2与1 mol Cl2反应生成2NA个HCl分子;C正确;D错,铜的电解精炼中,粗铜作阳极,其中粗铜中除铜外还有锌、铁、镍、金、银等金属,在阳极除铜放电外,锌、铁、镍也参与放电;
本题难度:一般
5、选择题 常温常压下NO2气体通入足量的水中,充分反应后,溶液的质量增加了54g。反应中有关物质的物理量正确的是(NA表示阿伏加德罗常数)
?
| 一氧化氮
| 硝酸
| 转移的电子
| A.
| 1mol
| ?
| 2NA
| B.
| 11.2L
| 1mol
| ?
| C.
| ?
| 63g
| 2mol
| D.
| ?
| 1mol
| ? NA
|
?
参考答案:D
本题解析:溶液的质量增加了54g,则:。
3NO2+H2O=2HNO3+NO?溶液增重△m
3mol? 2mol? 1mol? 3×46g-30g=108g
n(NO2)? n(HNO3)? n(NO)? 54g
故n(NO2)= =1.5mol,n(HNO3)= =1.5mol,n(HNO3)=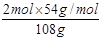 =1mol,n(NO)=0.5mol, =1mol,n(NO)=0.5mol,
A.由上述分析可知,n(NO)=0.5mol,反应中NO是还原产物,氮元素化合价由+4价降低为NO中+2价,转移电子数目为0.5mol×2×NAmol-1=NA,故A错误;B.由上述分析可知,n(HNO3)=1mol,n(NO)=0.5mol,常温常压下,气体摩尔体积不是22.4L/mol,大于22.4L/mol,故NO的体积大于0.5mol×22.4L/mol=11.2L,故B错误;C.由上述分析可知,n(HNO3)=1mol,故硝酸的质量为1mol×63g/mol=63g,n(NO)=0.5mol,故转移电子物质的量为0.5mol×2=1mol,故C错误;D.由上述分析可知,n(HNO3)=1mol,n(NO)=0.5mol,氮元素化合价由+4价降低为NO中+2价,转移电子数目为0.5mol×2×NAmol-1=NA,故D正确;故选D。
对象。
本题难度:一般
|