| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点整理《水的电离平衡》高频考点强化练习(2020年最新版)(十)
参考答案:C 本题解析:溶液呈中性时,一定有C(H+)= C(OH-)成立,而常温下pH=7的溶液为中性,此时C(H+)=1.0×10-7mol/L,未指明温度时,溶液不一定呈中性;酸与碱的强弱未指明,所以PH=3的酸与PH=11的碱等体积混合后的溶液不一定呈中性,所以答案选C。 本题难度:一般 3、实验题 16.(10分)实验室有一瓶混有氯化钠的氢氧化钠固体试剂,经测定NaOH的质量分数约为82.0%,为了验证其纯度,用浓度为0.2mol/L的盐酸进行滴定,试回答下列问题: |
参考答案:(1)①未冷却就转移,②烧杯未洗涤,③未用玻璃棒引流,④未用胶头滴管滴加至刻度线,⑤未振荡、摇匀。
(2)酸式;0刻度或0刻度以下某一位置
(3)碱式滴定管、锥形瓶;酚酞;浅红色;无
(4)80%
(5)A、C、E
本题解析:(1)溶解后的溶液应冷却后用玻璃棒引流转移最后摇匀;(2)盐酸应用酸式滴定管量取;(3)待测液为NaOH,选择碱式滴定管;用酚酞作指示剂时,滴定前,酚酞遇碱变浅红色,到达滴定终点时观察到溶液颜色由黄浅红色变为无色;(4)c(HCl)=0.2mol/L,V(HCl)=20.00mL,V(NaOH)=20.00mL,由c(酸)V(酸)=c(碱)V(碱)可知c(NaOH)=0.2mol/L,则500mL溶液中NaOH的物质的量为0.5L×0.2mol/L=0.1mol,则NaOH的质量为0.1mol×40g/mol=4.0g,所以5.0g样品中NaOH的质量分数为 ×100%=80%;(5)A.转移待测液至容量瓶时,未洗涤烧杯,NaOH的物质的量减少,消耗酸减少,则结果偏低;B.酸式滴定管用蒸馏水洗涤后,直接装盐酸,盐酸的浓度偏低,消耗酸偏大,结果偏大;C.滴定时,反应容器摇动太激烈,有少量液体溅出,NaOH的物质的量减少,消耗酸减少,则结果偏低;D.滴定到终点时,滴定管尖嘴悬有液滴,消耗盐酸偏大,结果偏大;E.读酸式滴定管开始时仰视,读数偏大,而读终点时俯视,读数偏小,二者之差偏小,消耗酸减少,则结果偏低。
×100%=80%;(5)A.转移待测液至容量瓶时,未洗涤烧杯,NaOH的物质的量减少,消耗酸减少,则结果偏低;B.酸式滴定管用蒸馏水洗涤后,直接装盐酸,盐酸的浓度偏低,消耗酸偏大,结果偏大;C.滴定时,反应容器摇动太激烈,有少量液体溅出,NaOH的物质的量减少,消耗酸减少,则结果偏低;D.滴定到终点时,滴定管尖嘴悬有液滴,消耗盐酸偏大,结果偏大;E.读酸式滴定管开始时仰视,读数偏大,而读终点时俯视,读数偏小,二者之差偏小,消耗酸减少,则结果偏低。
考点:酸碱中和滴定
点评:本题主要考察了酸碱中和滴定的相关知识,题目相对简单,但需要注意细节。
本题难度:一般
4、选择题 常温下,0.1mol·L—1某一元酸(HA)溶液中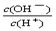 =1×10-8,下列叙述正确的是( )
=1×10-8,下列叙述正确的是( )
A.该一元酸溶液的pH=1 B.该溶液中HA的电离度为 1%
C.该溶液中水的离子积常数为1×10-14 D.若加水稀释,则c(OH-)/c(H+)将减小
参考答案:BC
本题解析:在常温下,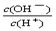 =1×10-8,Kw=10-14,所以c(H+)=10-3,所以一元酸溶液的pH=3,即A错误,C正确,该溶液中HA的电离度为10-3 /0.1*100%=1%,所以B也正确,D错误,加水则c(OH-)/c(H+)将增大,加水稀释pH变大,所以氢离子浓度变小,即c(OH-)/c(H+)将增大,所以答案为BC。
=1×10-8,Kw=10-14,所以c(H+)=10-3,所以一元酸溶液的pH=3,即A错误,C正确,该溶液中HA的电离度为10-3 /0.1*100%=1%,所以B也正确,D错误,加水则c(OH-)/c(H+)将增大,加水稀释pH变大,所以氢离子浓度变小,即c(OH-)/c(H+)将增大,所以答案为BC。
考点:酸的电离,Kw
点评:本题考查了酸的电离和水的离子积的相关计算,是高考考查的热点,该题难度适中。
本题难度:简单
5、选择题 下列物质的电离方程式,正确的是( ? )
A.KClO3→K++Cl-+3O2-
B.NaHCO3→Na++H++CO32-
C.HS-+H2O?H3O++S2-
D.CH3COONH4?NH4++CH3COO-
参考答案:C
本题解析:
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学必备知识点《影响盐类水.. | |