1、选择题 在强酸或强碱溶液中均能大量共存的离子组是
A.Ba2+、Cl-、NO3-、Na+
B.S2-、CO32-、K+、NH4+
C.Fe2+、NO3-、Cl-、HCO3-
D.Al3+、Cl-、AlO2-、Na+
参考答案:A
本题解析:分析:根据强酸或强碱溶液中离子之间不能结合生成水、气体、沉淀等,不能发生氧化还原反应,不能相互促进水解等,则离子能大量共存,以此来解答.
解答:A.强酸或强碱溶液中该组离子之间均不反应,能大量共存,故A正确;
B.S2-、CO32-分别与H+反应,OH-、NH4+结合生成弱电解质,则酸、碱溶液中均反应,不能共存,故B错误;
C.HCO3-既能与酸反应又能与碱反应,酸性溶液中Fe2+、NO3-发生氧化还原,碱溶液中Fe2+、OH-结合生成沉淀,则酸、碱溶液中均反应,不能共存,故C错误;
D.Al3+、AlO2-相互促进水解不能共存,且酸过碱溶液中均生成沉淀,则不能共存,故D错误;
故选A.
点评:本题考查离子的共存,注意习题中的信息及常见离子之间的反应即可解答,选项C为解答的难点,题目难度中等.
本题难度:简单
2、选择题 在投入铝片放出大量氢气的无色溶液中可能大量共存的离子组是
A.Na+、Fe2+、Cl-、ClO-
B.K+、NH4+、CO32-、Cl-
C.K+、Mg2+、Cl-、SO42-、
D.Na+、Cu2+、NO3-、Cl-
参考答案:C
本题解析:分析:投入铝片放出大量氢气的无色溶液,为酸或强碱溶液,再结合离子之间不能结合生成水、气体、沉淀,不能发生氧化还原反应等,则离子能大量共存.
解答:投入铝片放出大量氢气的无色溶液,为酸或强碱溶液,
A.酸溶液中Fe2+、ClO-发生氧化还原反应,碱溶液中Fe2+、OH-结合生成沉淀,则一定不能共存,且亚铁离子为浅绿色,故A错误;
B.酸溶液中H+、CO32-反应,碱溶液中NH4+、OH-反应,则一定不能共存,故B错误;
C.碱溶液中Mg2+、OH-反应,不能共存,而酸溶液中该组离子不反应,且与Al生成氢气,故C正确;
D.碱溶液中Cu2+、OH-反应,不能共存,且铜离子为蓝色,酸溶液中Al、NO3-发生氧化还原反应不生成氢气,故D错误;
故选C.
点评:本题考查离子的共存,明确题目中的信息及常见离子之间的反应即可解答,注意选项D为解答的易错点,题目难度不大.
本题难度:简单
3、选择题 下列离子方程式书写正确的是
A.少量通入FeBr2溶液中:2Fe2++Cl2═2Fe3++2Cl-
B.硫酸氢钠溶液中逐滴加过量氢氧化钡溶液,至溶液恰好呈中性:═BaSO4↓+H2O
C.澄清石灰水中加入盐酸:═
D.向AlCl3溶液中滴加过量氨水:Al3++4NH3?H2O═
参考答案:A
本题解析:分析:A.少量氯气只氧化亚铁离子;
B.溶液恰好呈中性,二者以2:1反应,生成硫酸钡、硫酸钠和水;
C.反应实质为氢离子与氢氧根离子反应;
D.反应生成氢氧化铝和氯化铵.
解答:A.少量Cl2通入FeBr2溶液中的离子反应为2Fe2++Cl2═2Fe3++2Cl-,故A正确;
B.硫酸氢钠溶液中逐滴加过量氢氧化钡溶液,至溶液恰好呈中性的离子反应为Ba2++2OH-+SO42-+2H+═BaSO4↓+2H2O,故B错误;
C.澄清石灰水中加入盐酸的离子反应为OH-+H+═H2O,故C错误;
D.向AlCl3溶液中滴加过量氨水的离子反应为Al3++3NH3?H2O═Al(OH)3↓+3NH4+,故D错误;
故选A.
点评:本题考查离子反应方程式的书写,明确发生的化学反应是解答本题的关键,注意与量有关的离子反应为解答的易错点,题目难度不大.
本题难度:困难
4、选择题 已知下列反应的热化学方程式为:
⑴C(s)+O2(g)=CO2(g)? ΔH 1=-393.5kJ/mol
⑵CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)? ΔH 2=-870.3kJ/mol
⑶H2(g)+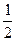 O2(g)=H2O(l)?ΔH 3=-285.8kJ/mol?
O2(g)=H2O(l)?ΔH 3=-285.8kJ/mol?
2C(s)+2H2(g)+O2(g)=CH3COOH(l)的反应热(焓变)为
A.488.3 kJ/mol
B.-488.3 kJ/mol
C.-244.15 kJ/mol
D.244.15 kJ/mol
参考答案:B
本题解析:由Hess 定律知ΔH=2ΔH1+Δ2H3-ΔH2=-488.3kJ/mol
本题难度:一般
5、填空题 (8分)如图所示,把试管放入盛有25℃时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5ml盐酸于试管中,试回答下列问题:

(1)实验中观察到的现象是
。
(2)产生该现象的原因
(3)写出有关反应的离子反应方程式
(4)由此推知,MgCl2溶液和H2的总能量 填(“大于”“小于”或“等于”)镁片和盐酸的总能量
参考答案:(1)向镁片表面产生气泡,逐渐减少;烧杯中有固体物质析出.
(2)镁跟盐酸反应产生氢气,并放出热量;Ca(OH)2的溶解度随温度的升高而变小.
(3)Mg+2H+
本题解析:
本题难度:一般