微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
选择题 取100mL?0.3mol/L和300mL?0.25mol/L的硫酸混合后加水配制成500mL溶液,该混合溶液中H+的物质的量浓 度是
A.0.21mol/L
B.0.42mol/L
C.0.56mol/L
D.0.24mol/L
来源:91考试网
选择题 取100mL?0.3mol/L和300mL?0.25mol/L的硫酸混合后加水配制成500mL溶液,该混合溶液中H+的物质的量浓度是
A.0.21mol/L
B.0.42mol/L
C.0.56mol/L
D.0.24mol/L
本题答案:B
本题解析:分析:先利用n=cV来计算每份硫酸溶液中硫酸的物质的量,从而计算出H+的物质的量,再利用混合后溶液的体积及c= 来计算H+的物质的量浓度.
来计算H+的物质的量浓度.
解答:100mL0.3mol/L硫酸溶液中硫酸的物质的量为0.1L×0.3mol/L=0.03mol,
300mL0.25mol/L的硫酸溶液中硫酸的物质的量为0.3L×0.25mol/L=0.075mol,
则混合后硫酸的物质的量为0.03mol+0.075mol=0.105mol,
H+的物质的量为0.105mol×2=0.21mol,
则该混合溶液中H+的物质的量浓度为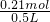 =0.42mol/L,
=0.42mol/L,
故选B.
点评:本题考查物质的量浓度的计算,明确物质的量、溶液的体积、浓度之间的关系及硫酸与氢离子的关系即可解答,难度不大.
本题所属考点:【配制一定物质的量浓度的溶液】
本题难易程度:【简单】
Youth is the season of hope. 青春是希望的季节.