微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
选择题 向Fe2(SO4)3、CuCl2混和溶液中投入足量的铁粉充分反应后,得到的固体经过滤、干燥、称重,知所得固体的质量与加入的铁粉的质量相等,则原溶液中c(SO42-)与c(Cl-)之比
A.3:2
B.1:7
C.2:7
D.3:14
选择题 向Fe2(SO4)3、CuCl2混和溶液中投入足量的铁粉充分反应后,得到的固体经过滤、干燥、称重,知所得固体的质量与加入的铁粉的质量相等,则原溶液中c(SO42-)与c(Cl-)之比
A.3:2
B.1:7
C.2:7
D.3:14
本题答案:D
本题解析:分析:向Fe2(SO4)3、CuCl2混和溶液中投入足量的铁粉,发生反应Fe+CuCl2=Cu+FeCl2,Fe+Fe2(SO4)3=3FeSO4,最后固体的质量与加入的铁粉的质量相等,则反应Fe+CuCl2=Cu+FeCl2导致固体增重等于反应Fe+Fe2(SO4)3=3FeSO4中参加反应的Fe的质量,假定反应Fe+Fe2(SO4)3=3FeSO4中参加反应的Fe的质量为56g,计算Fe2(SO4)3的物质的量,根据差量法计算计算CuCl2的物质的量,据此计算原溶液中c(SO42-)与c(Cl-)之比.
解答:向Fe2(SO4)3、CuCl2混和溶液中投入足量的铁粉,发生反应Fe+CuCl2=Cu+FeCl2,Fe+Fe2(SO4)3=3FeSO4,最后固体的质量与加入的铁粉的质量相等,则反应Fe+CuCl2=Cu+FeCl2导致固体增重等于反应Fe+Fe2(SO4)3=3FeSO4中参加反应的Fe的质量,
假定反应Fe+Fe2(SO4)3=3FeSO4中参加反应的Fe的质量为56g,物质的量为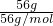 =1mol,由方程式可知F e2(SO4)3的物质的量为1mol,
=1mol,由方程式可知F e2(SO4)3的物质的量为1mol,
Fe+CuCl2=Cu+FeCl2?? 固体增重△m
??? 1mol???????????? 64g-56g=8g
? n(CuCl2)????????????? 56g
故n(CuCl2)=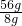 ×1mol=7mol,
×1mol=7mol,
故原溶液中c(SO42-):c(Cl-)=1mol×3:7mol×2=3:14
故选D.
点评:本题考查混合物的有关计算,难度中等,根据方程式分析反应Fe+CuCl2=Cu+FeCl2导致固体增重等于反应Fe+Fe2(SO4)3=3FeSO4中参加反应的Fe的质量是解题的关键.
本题所属考点:【有机化合物及其应用】
本题难易程度:【一般】
Take things as they come. 随遇而安。