微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
选择题 将一定质量的镁、铜组成的混合物加入足量稀硝酸中,金属完全溶解(假设反应中还原产物全部是NO).向反应后的溶液中加入过量的6mol/L?NaOH溶液至沉淀完全,测得生成沉淀的质量比原混合物的质量增加了7.65g,则下列叙述中正确的是
A.当金属全部溶解时收集到NO的体积为3.36 ?L
B.当生成的沉淀达到最大量时,形成沉淀需要NaOH溶液的体积为V=75?mL
C.参加反应的金属的总质量一定是9.9?g
D.当金属全部溶解时,参加反应的硝酸的物质的量一定是0.45?mol
选择题 将一定质量的镁、铜组成的混合物加入足量稀硝酸中,金属完全溶解(假设反应中还原产物全部是NO).向反应后的溶液中加入过量的6mol/L?NaOH溶 液至沉淀完全,测得生成沉淀的质量比原混合物的质量增加了7.65g,则下列叙述中正确的是
A.当金属全部溶解时收集到NO的体积为3.36?L
B.当生成的沉淀达到最大量时,形成沉淀需要NaOH溶液的体积为V=75?mL
C.参加反应的金属的总质量一定是9.9?g
D.当金属全部溶解时,参加反应的硝酸的物质的量一定是0.45?mol
本题答案:B
本题解析:分析:将一定量的镁和铜组成的混合物加入到稀HNO3中,金属完全溶解(假设反应中还原产物只有NO),发生反应:3Mg+8HNO3 (稀)=3Mg(NO3)2+2NO↑+4H2O;3Cu+8HNO3 (稀)=3Cu(NO3)2+2NO↑+4H2O;
向反应后的溶液中加入过量的6mol/L?NaOH溶液至沉淀完全,发生反应:Mg(NO3)2+2NaOH=Mg(OH)2↓+2NaNO3;Cu(NO3)2+2NaOH=Cu(OH)2↓+2NaNO3,沉淀为氢氧化镁和氢氧化铜,生成沉淀的质量比原合金的质量增加7.65g,则氢氧化镁和氢氧化铜含有氢氧根的质量为7.65g,氢氧根的物质的量为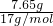 =0.45mol,则镁和铜的总的物质的量为0.225mol,
=0.45mol,则镁和铜的总的物质的量为0.225mol,
A.根据电子转移守恒计算NO物质的量,结合气体不一定是标准状况判断;
B.当生成的沉淀达到最大量时,溶液中溶质为NaNO3,硝酸根守恒可知n(NaNO3)=2n(硝酸铜+硝酸镁),由钠离子守恒由n(NaOH)=n(NaNO3),再根据V= 计算;
计算;
C.镁和铜的总的物质的量为0.225mol,金属的总质量与金属的含量有关;
D.根据氮元素守恒n(HNO3)=2n(硝酸铜+硝酸镁)+n(NO).
解答:将一定量的镁和铜组成的混合物加入到稀HNO3中,金属完全溶解(假设反应中还原产物只有NO),发生反应:3Mg+8HNO3 (稀)=3Mg(NO3)2+2NO↑+4H2O;3Cu+8HNO3 (稀)=3Cu(NO3)2+2NO↑+4H2O;
向反应后的溶液中加入过量的6mol/L?NaOH溶液至沉淀完全,发生反应:Mg(NO3)2+2NaOH=Mg(OH)2↓+2NaNO3;Cu(NO3)2+2NaOH=Cu(OH)2↓+2NaNO3,沉淀为氢氧化镁和氢氧化铜,生成沉淀的质量比原合金的质量增加7.65g,则氢氧化镁和氢氧化铜含有氢氧根的质量为7.65g,氢氧根的物质的量为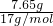 =0.45mol,则镁和铜的总的物质的量为0.225mol,
=0.45mol,则镁和铜的总的物质的量为0.225mol,
A.根据电子转移守恒可知生成的NO物质的量为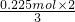 =0.15mol,若为标准状况下,生成NO的体积为0.15mol×22.4L/mol=3.36L,但NO不一定处于标准状况,故A错误;
=0.15mol,若为标准状况下,生成NO的体积为0.15mol×22.4L/mol=3.36L,但NO不一定处于标准状况,故A错误;
B.当生成的沉淀达到最大量时,溶液中溶质为NaNO3,硝酸根守恒可知n(NaNO3)=2n(硝酸铜+硝酸镁)=0.225mol×2=0.45mol,由钠离子守恒由n(NaOH)=n(NaNO3)=0.45mol,故此时氢氧化钠溶液的体积为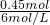 =0.075L=75mL,故B正确;
=0.075L=75mL,故B正确;
C、镁和铜的总的物质的量为0.225mol,假定全为镁,质量为0.225mol×24g/mol=5.4g,若全为铜,质量为0.225mol×64g/mol=14.4g,所以参加反应的金属的总质量(m)为5.4g<m<14.4g,故C错误;
D、根据氮元素守恒n(HNO3)=2n(硝酸铜+硝酸镁)+n(NO)=0.225mol×2+0.15mol=0.6mol,故D错误;
故选B.
点评:本题主要考查混合物有关计算,涉及镁铜与硝酸反应、生成的盐与氢氧化钠反应,综合考查学生的得失电子守恒、质量守恒等综合运用和解决复杂问题的能力,是一道考查能力的好题,难度较大.
本题所属考点:【有机化合物及其应用】
本题难易程度:【一般】
He who knows most knows best how little he knows. 知识愈多就愈了解自己懂得太少.