微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
选择 题 将13.7g?Na2CO3与NaHCO3的混合物充分加热,共收集到标准状况下的气体1.12L,则混合物中Na2CO3与NaHCO3的物质的量之比为
A.1:1
B.2:1
C.1:2
D.3:1
选择题 将13.7g?Na2CO3与NaHCO3的混合物充分加热,共收集到标准状况下的气体1.12L,则混合物中Na2CO3与NaHCO3的物质的量之比为
A.1:1
B.2:1
C.1:2
D.3:1
本题答案:C
本题解析:分析:固体加热时发生2 NaHCO3 Na2CO3+CO2↑+H2O,由充分反应生成的气体可计算混合物中NaHCO3质量,再计算碳酸钠的质量,根据n=
Na2CO3+CO2↑+H2O,由充分反应生成的气体可计算混合物中NaHCO3质量,再计算碳酸钠的质量,根据n= 计算各自的物质的量.
计算各自的物质的量.
解答:令化合物中碳酸氢钠的质量为m,则:
2NaHCO3 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
168g??????????? 22.4L
m?????????????? 1.12L
所以m=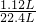 ×168g=8.4g
×168g=8.4g
所以碳酸氢钠的物质的量为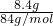 =0.1mol,
=0.1mol,
碳酸钠的质量为13.7g-8.4g=5.3g,物质的量为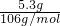 =0.05mol,
=0.05mol,
故混合物中Na2CO3与NaHCO3的物质的量之比为0.05mol:0.1mol=1:2,
故选C.
点评:考查混合物的计算、根据方程式的计算,比较基础,清楚反应过程是解题的关键,加强基础知识的掌握.
本题所属考点:【金属及其化合物】
本题难易程度:【困难】
The moon is not seen where the sun shines. 日出月不见。