微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
选择题 27.2g铁粉和氧化铁的混合物,放入500mL稀H2SO4中,发现固体完全溶解,并放出4.48L?H2(标况),加入NH4SCN溶液后,无颜色变化,然后向溶液中加入2mol?L-1?NaOH溶液,当溶液呈中性时,用掉NaOH溶液500mL,则原硫酸溶液的物质的量浓度为
A.4mol?L-1
B.3mol?L-1
C.2mol?L-1
D.1mol?L-1
选择题 27.2g铁粉和氧化铁的混合物,放入500mL稀H2SO4中,发现固体完全溶解,并放出4.48L?H2(标况),加入NH4SCN溶液后,无颜色变化,然后向溶液中加入2mol?L-1?NaOH溶液,当溶液呈中性时,用掉NaOH溶液500mL,则原硫酸溶液的物质的量浓度为
A.4mol?L-1
B.3mol?L-1
C.2mol?L-1
D.1mol?L-1
本题答案:D
本题解析:分析:向反应后混合溶液中滴加NaOH溶液,当溶液呈中性时,此时为硫酸钠溶液,根据硫酸根守恒有n(Na2SO4)=n(H2SO4),根据钠离子守恒有n(NaOH)=2n(Na2SO4),据此计算硫酸的物质的量,最终求出原硫酸的物质的量浓度.
解答:向反应后混合溶液中滴加NaOH溶液,当溶液呈中性时,此时为硫酸钠溶液,根据钠离子守恒有:
n(NaOH)=2n(Na2SO4),
根据硫酸根守恒有n(H2SO4)=n(Na2SO4)= 91eXaM.org n(NaOH)=
n(NaOH)= ×0.5L×2mol/L=0.5mol,
×0.5L×2mol/L=0.5mol,
所以原硫酸的物质的量浓度为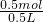 =1mol/L.
=1mol/L.
故选D.
点评:本题涉及的化学反应比较多,计算过程也很复杂,用守恒法计算,不但思路清楚,而且解题简单.
本题所属考点:【金属及其化合物】
本题难易程度:【一般】
Ignorance of the law excuses no man. 不知法不能使任何人免罪.