微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
选择题 将2a?L Al2(SO4)3和(NH4)2SO4的混合物溶液分为两等份,其中一份加入b?mol BaCl2,恰好使溶液中的SO42-离子完全沉淀;另一份加入足量强碱并加热可得到c?mol N 91EXAM.orgH3气,则原混合溶液中的Al3+离子浓度(mol/L)为
A.
B.
C.
D.
选择题 将2a?L Al2(SO4)3和(NH4)2SO4的混合物溶液分为两等份,其中一份加入b?mol BaCl2,恰好使溶液中的SO42-离子完全沉淀;另一份加入足量强碱并加热可得到c?mol NH3气,则原混合溶液中的Al3+离子浓度(mol/L)为
A.
B.
C.
D.
本题答案:C
本题解析:分析:根据SO42-+Ba2+═BaSO4↓计算溶液中的SO4来源:91考试网 91exam.org2-离子的物质的量,根据NH4++OH- NH3↑+H2O计算NH4+的物质的量,再根据c=
NH3↑+H2O计算NH4+的物质的量,再根据c=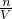 计算SO42-离子、NH4+离子浓度,再利用电荷守恒有3n(Al3+)+c(NH4+)=2c(SO42-),据此计算原溶液中的Al3+浓度.
计算SO42-离子、NH4+离子浓度,再利用电荷守恒有3n(Al3+)+c(NH4+)=2c(SO42-),据此计算原溶液中的Al3+浓度.
解答:向aL混合溶液中加入bmolBaCl2,恰好使溶液中的SO42-离子完全沉淀,则:
SO42-+Ba2+═BaSO4↓
bmol?bmol
c(SO42-)=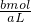 =
=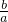 mol/L,
mol/L,
向aL混合溶液中加入足量强碱并加热可得到cmolNH3,则:
NH4++OH- NH3↑+H2O
NH3↑+H2O
cmol???? ?cmol
c(NH4+)= =
= mol/L,
mol/L,
又溶液不显电性,设原溶液中的Al3+浓度为x,由电荷守恒可知,
x×3+ mol/L×1=
mol/L×1=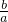 mol/L×2,
mol/L×2,
解得x= mol/L,
mol/L,
故选C.
点评:本题考查混合物的有关计算、根据离子方程的计算、物质的量浓度的计算等,清楚发生的离子反应及溶液不显电性是解答本题的关键,熟悉物质的量浓度的计算公式.
本题所属考点:【金属及其化合物】
本题难易程度:【简单】
Better the last smile than the first laughter. 宁可最后微笑,不要首先狂喜.