微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
选择题 将15mL?2mol?L-1?Na2CO3溶液逐滴加入到40mL?0.5mol?L-1?MCln盐溶液中,恰好将溶液中的Mn+离子完全沉淀为碳酸盐,则MCln中n值是
A.4
B.3
C.2
D.1
来源:91考试 网
选择题 将15mL?2mol?L-1?Na2CO3溶液逐滴加入到40mL?0.5mol?L-1?MCln盐溶液中,恰好将溶液中的Mn+离子完全沉淀为碳酸盐,则MCln中n值是
A.4
B.3
C.2
D.1
本题答案:B
本题解析:分析:根据Na2CO3溶液与MCln盐溶液反应时,恰好将溶液中的Mn+离子完全沉淀为碳酸盐,利用化合价得出Mn+离子与nCO32-离子的关系,然后利用物质的量来计算解答.
解答:Na2CO3溶液中nCO32-离子的物质的量为15mL×10-3×2mol?L-1=0.03mol,
MCln盐溶液中Mn+离子的物质的量为40mL×10-3×0.5mol?L-1=0.02mol,
由反应中恰好将溶液中的Mn+离子完全沉淀为碳酸盐,及M的化合价为+n,
则Na2CO3与MCln反应对应的关系式为:
??? ?2Mn+~nCO32-
??? ?2???? n
0.02mol??? 0.03mol
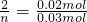 ,解得n=3,
,解得n=3,
故选:B.
点评:本题考查学生利用溶液中的离子之间的反应来进行简单计算,明确离子之间的关系是解答的关键,并应熟悉离子的物质的量的计算来解答即可.
本题所属考点:【电解质溶液】
本题难易程度:【简单】
Fine words butter no parsnips. 花言巧语没有用.