微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
选择题 用NA表示阿伏加德罗常数的数值,下列说法中正确的是
A.盛有CO2的密闭容器中含有NA个氧原子,则C的物质的量不一定是0.5mol
B.常 温下,5.6g铁与足量的盐酸反应,失去的电子数为0.3NA
C.常温常压下,氧气和臭氧的混合物16g中含有NA个氧原子
D.1mol?L-1NaCl溶液含有NA个Na+离子
选择题 用NA表示阿伏加德罗常数的数值,下列说法中正确的是
A.盛有CO2的密闭容器中含有NA个氧原子,则C的物质的量不一定是0.5mol
B.常温下,5.6g铁与足量的盐酸反应,失去的电子数为0.3NA
C.常温常压下,氧气和臭氧的混合物16g中含有NA个氧原子
D.1mol?L-1NaCl溶液含有NA个Na+离子
本题答案:C
本题解析:分析:A、根据n=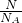 计算氧原子的物质的量,结合二氧化碳的分子式计算碳原子的物质的量.
计算氧原子的物质的量,结合二氧化碳的分子式计算碳原子的物质的量.
B、铁与盐酸反应生成氯化亚铁,铁表现+2价,据此计算转移电子数.
C、氧气和臭氧都是由氧元素组成的,16g为氧原子的质量,根据n= 计算氧原子的物质的量,再根据N=NA计算氧原子数目.
计算氧原子的物质的量,再根据N=NA计算氧原子数目.
D、溶液体积未给出,无法计算.
解答:A、氧原子的物质的量为 =1mol,氧原子与碳原子的物质的量之比为2:1,所以碳原子的物质的量为1mol×
=1mol,氧原子与碳原子的物质的量之比为2:1,所以碳原子的物质的量为1mol× =0.5mol,故A错误;
=0.5mol,故A错误;
B、铁与盐酸反应生成氯化亚铁,铁表现+2价,5.6g铁与足量的盐酸反应失去的电子数为 ×2×NAmol-1=0.2NA,故B错误;
×2×NAmol-1=0.2NA,故B错误;
C、氧气和臭氧都是由氧元素组成的,16g为氧原子的质量,所以16g氧气和臭氧的混合物中含氧原子数为 ×NAmol-1=NA,故C正确;
×NAmol-1=NA,故C正确;
D 、溶液体积未给出,无法计算钠离子数目,故D错误.
故选:C.
点评:考查常用化学计量数的有关计算,难度不大,注意铁与盐酸反应生成氯化亚铁,与氯气反应生成氯化铁.
本题所属考点:【化学实验】
本题难易程度:【一般】
An idea isn't responsible for the people who believe in it. 一个思想对信仰它的人并不负有责任。