微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
实验题 (14分)金属钛(Ti)性能优越,被称为继铁、铝之后的“第三金属”。工业上以钛铁矿(主要成分FeTiO3,含FeO、Al2O3、SiO2等杂质)为主要原料冶炼金属钛,其生产的工艺流程图如下:
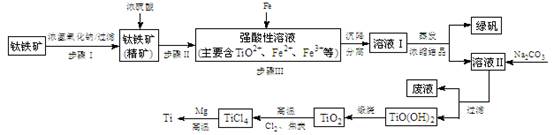
已知:2H2SO4(浓)+ FeTiO3=TiOSO4 + FeSO4 + 2H2O
(1)步骤I中发生反应的离子方程式: 、 。
(2)已知:TiO2+易水解,只能存在于强酸性溶液中。
25 ℃时,难溶电解质溶解度与pH关系如图,
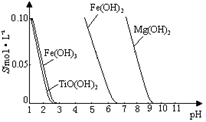
TiO(OH)2溶度积Ksp=1×10-29
①步骤Ⅲ加入铁屑原因 是 。
② TiO2+水解的离子方程式为 。
向溶液II中加入Na2CO3粉末的作用是 。
当溶液pH= 时,TiO(OH)2已沉淀完全。
(3)TiCl4→Ti反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于 ℃即可。
| TiCl4
| Mg
| MgCl2
| Ti
|
熔点/℃
| -25.0
| 648.8
| 714
| 1667
|
沸点/℃
| 136.4
| 1090
| 1412
| 3287
|
(4)电解TiO2制备钛的方法如图所示。该方法由于具备生产过程简化、生产成本低、产品质量高、环境友好等诸多优点而引人注目。已知TiO2熔融状态下不发生电离,电解时阴极反应式为 。

实验题 (14分)金属钛(Ti)性能优越,被称为继铁、铝之后的“第三金属”。工业上以钛铁矿(主要成分FeTiO3,含FeO、Al2O3、SiO2等杂质)为主要原料冶炼金属钛,其生产的工艺流程图如下:

已知:2H2SO4(浓)+ FeTiO3=TiOSO4 + FeSO4 + 2H2O
(1)步骤I中发生反应的离子方程式: 、 。
(2)已知:TiO2+易水解,只能存在于强酸性溶液中。
25 ℃时,难溶电解质溶解度与pH关系如图,

TiO(OH)2溶度积Ksp=1×10-29
①步骤Ⅲ加入铁屑原因 是 。
② TiO2+水解的离子方程式为 。
向溶液II中加入Na2CO3粉末的作用是 。
当溶液pH= 时,TiO(OH)2已沉淀完全。
(3)TiCl4→Ti反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于 ℃即可。
| TiCl4
| Mg
| MgCl2
| Ti
|
熔点/℃
| -25.0
| 648.8
| 714
| 1667
|
沸点/℃
| 136.4
| 1090
| 1412
| 3287
|
(4)电解TiO2制备钛的方法如图所示。该方法由于具备生产过程简化、生产成本低、产品质量高、环境友好等诸多优点而引人注目。已知TiO2熔融状态下不发生电离,电解时阴极反应式为 。

本题答案:(14分)
(1)Al2O3+2OH-=2AlO2-+
本题解析:
试题分析:(1)根据钛铁矿的成分可知与氢氧化钠溶液反应的物质是氧化铝和二氧化硅,离子方程式为Al2O3+2OH-=2AlO2-+H2O(或Al2O3+2OH-+3H2O=2[Al(OH)4]-)(2分)
SiO2+2OH-=SiO32-+H2O;
(2)①由图可知TiO(OH)2与Fe(OH)3沉淀的pH很接近,所以加入铁粉目的是将Fe3+转化为Fe2+,防止Fe3+与TiO2+同时生成沉淀;
②TiO2+易水解,只能存在于强酸性溶液中,所以TiO2+水解生成TiO(OH)2与H+ ,离子方程式为TiO2++2H2O TiO(OH)2+2H+ ; 从流程图中可看出加入碳酸钠溶液后得到TiO(OH)2沉淀,所以向溶液II中加入Na2CO3粉末的作用是调节溶液pH值,使TiO2+水解平衡正向移动;由图可知,pH=2时TiO(OH)2已沉淀完全。
TiO(OH)2+2H+ ; 从流程图中可看出加入碳酸钠溶液后得到TiO(OH)2沉淀,所以向溶液II中加入Na2CO3粉末的作用是调节溶液pH值,使TiO2+水解平衡正向移动;由图可知,pH=2时TiO(OH)2已沉淀完全。
(3)Mg、MgCl2的沸点最高是1412℃,而Ti的熔点为1667℃,所以当温度略高于1412℃时Mg、MgCl2以气体的形式除去,得到Ti;
(4)电解时阴极发生还原反应,因为TiO2熔融状态下不发生电离,所以是TiO2得电子生成Ti单质和O2-,电极反应式为TiO2+4e-=Ti+2O2-。
考点:考查物质的制备,流程图的分析,化学平衡的应用,电化学理论的应用
本题所属考点:【电解池原理】
本题难易程度:【一般】
It is better to trust to valour than to luck. 靠运气不如靠勇气.