微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 (8分)在下图中,E和F分别为电源两极;甲烧杯中盛有100 mL 0.2mol·L-1 AgNO3溶液,乙烧杯中盛有100 mL 0.15 mol·L-1 CuCl2溶液,A、B、C、D均为石墨电极,如果电解一段时间后,发现B极增重1.08g,则
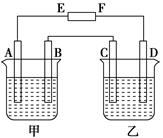
(1)E为________极,C为________极。
(2)A极的电极反应式为_________________________,析出气体________mL。(标准状况)
( 3)若乙烧杯溶液体积不变,则此时溶液的物质的量浓度将变为 mol·L-1。
(4)甲烧杯中滴入石蕊试液,________极附近变红(填A或B);如果继续电解,在甲烧杯中最终得到________溶液(填溶质的化学式)。
填空题 (8分)在下图中,E和F分别为电源两极;甲烧杯中盛有100 mL 0.2mol·L-1 AgNO3溶液,乙烧杯中盛有100 mL 0.15 mol·L-1 CuCl2溶液,A、B、C、D均为石墨电极,如果电解一段时间后,发现B极增重1.08g,则

(1)E为________极,C为________极。
(2)A极的电极反应式为_________________________,析出气体________mL。(标准状况)
(3)若乙烧杯溶液体积不变,则此时溶液的物质的量浓度将变为 &#来源:91考试网 91ExAm.org160;mol·L-1。
(4)甲烧杯中滴入石蕊试液,________极附近变红(填A或B);如果继续电解,在甲烧杯中最终得到________溶液(填溶质的化学式)。
本题答案:(8分)
(1)正
本题解析:
试题分析:(1)根据题意,B极增重1.08g,说明B极有Ag析出,所以B是阴极,A是阳极,则C是阳极,D是阴极,E是正极,F是负极;
(2)A极发生氧化反应,氢氧根离子的放电能量大于硝酸根离子,所以氢氧根离子放电,失去电子生成氧气,则电极反应式为4OH--4e-===2H2O+O2↑;因为析出Ag的质量是1.08g,物质的量是1.08g/108g/mol=0.01mol,转移电子的物质的量是0.01mol,根据得失电子守恒,生成氧气的物质的量是0.01mol/4,标准状况下的体积是0.01mol/4×22.4L/mol=0.056L=56mL;
(3)乙烧杯是电解氯化铜溶液,两极发生的反应分别是Cu2++2e-==Cu、2Cl--2e-=Cl2↑,当甲中有0.01mol电子转移时,乙析出CuCl2的物质的量是0.005mol,则溶液中剩余CuCl2的物质的量是0.1L×0.15mol/L-0.005mol=0.01mol,所以此时氯化铜溶液的浓度是0.01mol/0.1L=0.1mol/L;
(4)酸使石蕊变红色,甲中A极是氢氧根离子放电,所以氢离子浓度增大,所以A极变红色;继续电解,则甲中析出Ag和氧气,则溶液中剩余氢离子和硝酸根离子,所以最终得到HNO3溶液。
考点:考查电解反应原理的应用,氧化还原反应的计算
本题所属考点:【电解池原理】
本题难易程度:【一般】
It is good to have friends in trouble. 患难得友是幸事.