微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 (12分)Al及其化合物用途广泛,工业上可以将明矾石经处理后得到明矾[KAl(SO4)2·12H2O],再将明矾焙烧后制得Al2O3等物质,进一步处理后还可以得到Al。
已知焙烧明矾的化学方程式为:
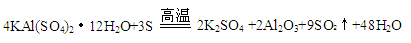
请回答:
(1)Al2O3的摩尔质量是 。
(2)工业上可用电解Al2O3制备Al,其化学方程式是 。
(3)在焙烧明矾的反应中,氧化剂和还原剂的物质的量之比是 。
(4)焙烧明矾时产生的SO2可综合利用来制硫酸。
已知25℃、101 kPa时:
2SO2(g) +O2(g) 2SO3(g) △H1 = 一197 kJ/mol
2SO3(g) △H1 = 一197 kJ/mol
2H2O (g)=2H2O(1) △H2 = 一44 kJ/mol
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l) △H3 = 一545 kJ/mol
SO3(g)与H2O(l)反应的热化学方程式是 。
(5)以Al和NiO(OH)为电极,NaOH溶液为电解液可以组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2。
①该电池的负极反应式 。
②电池总反应的化学方程式 。
填空题 (12分)Al及其化合物用途广泛,工业上可以将明矾石经处理后得到明矾[KAl(SO4)2·12H2O],再将明矾焙烧后制得Al2O3等物质,进一步处理后还可以得到Al。
已知焙烧明矾的化学方程 www.91eXam.org式为:
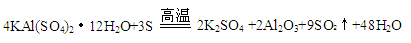
请回答:
(1)Al2O3的摩尔质量是 。
(2)工业上可用电解Al2O3制备Al,其化学方程式是 。
(3)在焙烧明矾的反应中,氧化剂和还原剂的物质的量之比是 。
(4)焙烧明矾时产生的SO2可综合利用来制硫酸。
已知25℃、101 kPa时:
2SO2(g) +O2(g) 2SO3(g) △H1 = 一197 kJ/mol
2SO3(g) △H1 = 一197 kJ/mol
2H2O (g)=2H2O(1) △H2 = 一44 kJ/mol
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l) △H3 = 一545 kJ/mol
SO3(g)与H2O(l)反应的热化学方程式是 。
(5)以Al和NiO(OH)为电极,NaOH溶液为电解液可以组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2。
①该电池的负极反应式 。
②电池总反应的化学方程式 。
本题答案:(12分)
(1) 102 g/mol &#
本题解析:
试题分析:(1)Al2O3的摩尔质量在数值等于相对分子质量,所以Al2O3的摩尔质量为:102 g/mol
(2)电解熔融的Al2O3生成Al和O2,所以化学方程式为:
(3)根据焙烧明矾的化学方程式 可知,氧化剂和还原剂的物质的量之比=6:3=2:1.
可知,氧化剂和还原剂的物质的量之比=6:3=2:1.
(4)首先写出SO3与H2O反应的化学方程式并注明状态:SO3(g)+ H2O(g) = H2SO4(l),然后根据盖斯定律计算焓变,?H=—1/2△H1+1/2△H2 +1/2△H3 =-152kJ·mol-1,故热化学方程式为:SO3(g)+ H2O(l) = H2SO4(l) △H= -152kJ·mol-1
(5)①Al为活泼金属,在负极上失去电子,所以电极方程式为:Al-3e- + 4OH-= AlO2-+2H2O
②正极上NiO(OH)得电子转化为Ni(OH)2,可得电池总反应的化学方程式为:Al+3NiO(OH)+NaOH+H2O=NaAlO2+3Ni(OH)2
考点:本题考查摩尔质量、方程式的书写、氧化还原反应、原电池原理。
本题所属考点:【电解池原理】
本题难易程度:【困难】
A watched pot never boils. 心急锅不开.