微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 (10分)目前工业上有一种用CO2来生产燃料甲醇的方法,可以将CO2变废为宝。
(1)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=_1275.6kJ?mol-1
②2CO(g)+O2(g)=2CO2(g)△H=_556.0kJ?mol-1
③H2O(g)=H2O(l)△H=-44.0kJ?mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:___________________。
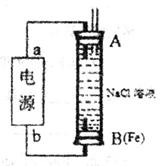
(2)某同学利用甲醇(酸性)燃料电池为电源,设计了一种电解法制取Fe(OH)2的实验装置(如下图)。通电后,下图竖直装置下端B极上有大量气泡产生,溶液中产生大量的Fe(OH)2白色沉淀,且较长时间不变色。则电源中b极为______极(填“正”或“负”),其电极反应式为__________________,装置上端A极电极材料是: ____(填化学式),B电极上的电极反应式为____________。
(3)利用电解法在铁制品上镀铜可以防止铁被腐蚀,以下说法正确的是_____。
a.电镀 时,通常用铜做阳极,可溶性铜盐作电解质溶液
b. 电镀过程中,维持电流恒定,温度升高,电解反应速率加快
c.电镀过程中,电能全部转化为化学能
d.电镀过程中,铜离子向阴极移动,发生还原反应
填空题 (10分)目前工业上有一种用CO2来生产燃料甲醇的方法,可以将CO2变废为宝。
(1)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=_1275.6kJ?mol-1
②2CO(g)+O2(g)=2CO2(g)△H=_556.0kJ?mol-1
③H2O(g)=H2O(l)△H=-44.0kJ?mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:___________________。
(2)某同学利用甲醇(酸性)燃料电池为电源,设计了一种电解法制取Fe(OH)2的实验装置(如下图)。通电后,下图竖直装置下端B极上有大量气泡产生,溶液中产生大量的Fe(OH)2白色沉淀,且较长时间不变色。则电源中b极为______极(填“正”或“负”),其电极反应式为__________________,装置上端A极电极材料是: ____(填化学式),B电极上的电极反应式为____________。

(3)利用电解法在铁制品上镀铜可以防止铁被腐蚀,以来源:91考试网下说法正确的是_____。
a.电镀时,通常用铜做阳极,可溶性铜盐作电解质溶液
b. 电镀过程中,维持电流恒定,温度升高,电解反应速率加快
c.电镀过程中,电能全部转化为化学能
d.电镀过程中,铜离子向阴极移动,发生还原反应
本题答案:(1)CH3OH(l)+O2(g)→ CO(g)+2H2O(
本题解析:
试题分析:(1)①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=_1275.6kJ?mol-1,②2CO(g)+O2(g)=2CO2(g)△H=_556.0kJ?mol-1,③H2O(g)=H2O(l)△H=-44.0kJ?mol-1,依据热化学方程式和盖斯定律(①-②+③×4)÷2得到CH3OH(l)+O2(g)="CO" (g)+2H2O(l)△H=_442.8 kJ?mol-1;
(2)甲醇燃料电池为电源电解法制取Fe(OH)2的实验装置,通电后,溶液中产生大量的白色沉淀,且较长时间不变色,说明氢氧化亚铁在B电极附近生成,所以电极A为电解池的阳极,B为电解池的阴极,电源a为正极,电极反应为氧气得到电子得到电子发生还原反应,O2+4e-+2H2O=4OH-;连接正极的A电极是铁,目的是铁做阳极失电子生成亚铁离子,和阴极生成的氢氧根离子反应生成白色沉淀氢氧化亚铁;b为负极,甲醇失去电子,电极反应式为CH3OH-6e-+H2O=CO2+6H+,连接电极B电极反应为:2H++2 e-=H2↑;
(3)a.铁上镀铜时,通常用铜做阳极,可溶性铜盐作电解质溶液,正确;b. 电镀过程中,维持电流恒定,温度升高,电阻增大,电解反应速率减小,错误;c.电镀过程中,电能没有全部转化为化学能,部分转化为热能,错误;d.电镀过程中,铜离子向阴极移动,发生还原反应,正确,答案选ad。
考点:考查热化学方程式和盖斯定律计算应用,原电池,电解池原理分析
本题所属考点:【电解池原理】
本题难易程度:【困难】
The wind cannot be caught in a net. 撒网捕风,徒劳无功.