微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 (14分)汽车尾气中CO、NOx 以及燃煤废弃中的SO2都是大气污染物,对它们的治理具有重要意义。
Ⅰ.CH4(g)+4NO2(g) = 4NO(g)+CO2(g)+2H2O(g) △H1=" —574" kJ·mol- 1.
CH4(g) + 4NO(g) = 2N2(g)+ CO2(g)+2H2O(g) △H2= 一1160 kJ·mol- 1
(1)甲烷直接将NO2还原为N2的热化学方程式为 ;
Ⅱ.吸收SO2和NO,获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素):
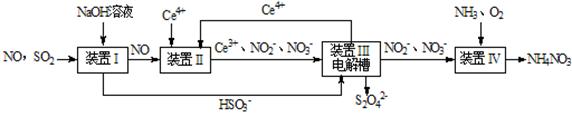
(2)装置Ⅱ中,酸性条件下,NO被Ce 4+ 氧化的产物主要是NO3- 、NO2- ,写出只生成NO3- 的离子方程式 ;
(3)装置Ⅲ的作用之一是再生Ce4+,其原理如下图所示。
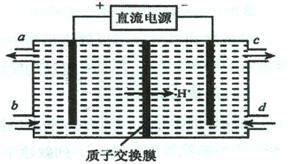
①生成的Ce4+ 从电解槽的 (填字母序号)口流出;
②生成S2O42 - 的电极反应式为 ;
(4)已知进入装置Ⅳ的溶液中,NO2- 的浓度为a g·L- 1 ,要使1m3该溶液中的NO2- 完全转化为NH4NO3,至少需向装置Ⅳ中通入标准状况下的O2 L。(用含a代数式表示,计算结果保留整数)
填空题 (14分)汽车尾气中CO、NOx 以及燃煤废弃中的SO2都是大气污染物,对它们的治理具有重要意义。
Ⅰ.CH4(g)+4NO2(g) = 4NO(g)+CO2(g)+2H2O(g) △H1=" —574" kJ·mol- 1.
CH4(g) + 4NO(g) = 2N2(g)+ CO2(g)+2H2O(g) △H2= 一1160 kJ·mol- 1
(1)甲烷直接将NO2还原为N2的热化学方程式为 ;
Ⅱ.吸收SO2和NO,获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素):

(2)装置Ⅱ中,酸性条件下,NO被Ce 4+ 氧化的产物主要是NO3- 、NO2- ,写出只生成NO3- 的离子方程式 ; ;
(3)装置Ⅲ的作用之一是再生Ce4+,其原理如下图所示。

①生成的Ce4+ 从电解槽的 (填字母序号)口流出;
②生成S2O42 - 的电极反应式为 ;
(4)已知进入装置Ⅳ的溶液中,NO2- 的浓度为a g·L- 1 ,要使1m3该溶液中的NO2- 完全转化为NH4NO3,至少需向装置Ⅳ中通入标准状况下的O2 L。(用含a代数式表示,计算结果保留整数)
本题答案:(1)CH4(g)+2NO2(g)=2H2O(g)+ CO2
本题解析:
试题分析:(1)根据盖斯定律,将两个已知热化学方程式相加得2CH4(g)+4NO2(g)=4H2O(g)+2 CO2(g)+2N2(g) △H=(—574 kJ·mol- 1)+(一1160 kJ·mol- 1)=-1734kJ/mol,所以甲烷直接将NO2还原为N2的热化学方程式为CH4(g)+2NO2(g)=2H2O(g)+ CO2(g)+N2(g) △H=-867kJ/mol
(2)由图可知,NO被Ce 4+ 氧化为NO3- ,则Ce4+被还原为Ce3+,所以只生成NO3- 的离子方程式为NO+2H2O+3Ce4+=3Ce3++NO3-+4H+
(3)①装置Ⅲ的作用之一是再生Ce4+,在电解池中,阳极上是Ce3+失电子成为Ce4+的过程,所以生成Ce4+从电解槽的阳极上a极流出,
②电解池的阴极发生得电子的还原反应,亚硫酸氢根离子得电子生成S2O42-,电极反应式为2H++2HSO3-+2e-=S2O42-+2H2O
(4)NO2-的浓度为a g?L-1,要使1m3该溶液中的NO2-完全转化为NH4NO3,则失去电子的物质的量是(1000×ag)/46g/mol×(5-3),设需要标准状况下的O2VL,则氧气得电子的物质的量是VL/22.4L/mol×2×(2-0),根据氧化还原反应中得失电子守恒定律,有(1000×ag)/46g/mol×(5-3)= VL/22.4L/mol×2×(2-0),解得V=243aL。
考点:考查盖斯定律的应用,离子方程式的书写,电化学反应原理的应用,氧化还原反应的计算
本题所属考点:【电解池原理】
本题难易程度:【一般】
A glass at supper is not amiss. 晚酌一杯也无妨。