|
|
|
(11分)以食盐为原料进行生产并综合利用的某些过程如下图所示。【电解池原理】
2016-12-24 00:40:27
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 (11分)以食盐为原料进行生产并综合利用的某些过程如下图所示。
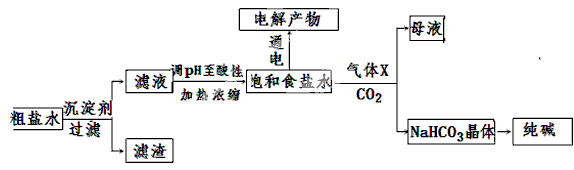
(1)除去粗盐中的Ca2+、Mg2+和SO42-离子,加入下列沉淀剂的顺序是(填字母) 。
a.Na2CO3 b.NaOH c.BaCl2
(2)将滤液的pH调至酸性除去的离子是 & 91eXAm.org#160; 。
(3)电解饱和食盐水可得到H2和另外两种产物,这两种物质相互反应的离子方程式为 ,欲从饱和食盐水中获得食盐晶体,可采用的实验方法是 。
(4)气体X可增大饱和食盐水吸收CO2的量,有利于NaHCO3晶体的生成和析出,X的化学式是 。
(5)下列有关NaHCO3和纯碱的说法正确的是 (填字母)
A.NaHCO3属于盐类,纯碱属于碱
B.分别往同浓度的NaHCO3溶液和纯碱溶液中滴加稀盐酸,产生气泡的速率相同
C.常温下在水中的溶解度,NaHCO3大于纯碱
D.除去NaHCO3溶液中的纯碱,应往溶液中通入足量的CO2
|
填空题 (11分)以食盐为原料进行生产并综合利用的某些过程如下图所示。

(1)除去粗盐中的Ca2+、Mg2+和SO42-离子,加入下列沉淀剂的顺序是(填字母) 。
a.Na2CO3 b.NaOH c.BaCl2
(2)将滤液的pH调至酸性除去的离子是 。
(3)电解饱和食盐水可得到H2和另外两种产物,这两种物质相互反应的离子方程式为 ,欲从饱和食盐水中获得食盐晶体,可采用的实验方法是 ; 。
(4)气体X可增大饱和食盐水吸收CO2的量,有利于NaHCO3晶体的生成和析出,X的化学式是 。
(5)下列有关NaHCO3和纯碱的说法正确的是 (填字母)
A.NaHCO3属于盐类,纯碱属于碱
B.分别往同浓度的NaHCO3溶液和纯碱溶液中滴加稀盐酸,产生气泡的速率相同
C.常温下在水中的溶解度,NaHCO3大于纯碱
D.除去NaHCO3溶液中的纯碱,应往溶液中通入足量的CO2
|
本题答案:(1)cab或者cba或者bca (2)CO32-
本题解析:
试题分析:(1)总体思路是先沉淀再过滤,沉淀时要先加BaCl2溶液,再加Na2CO3溶液,因为碳酸钠能把过量的氯化钡沉淀出来,氢氧化钠可放在它们前面,也可放在它们后面或中间,都完全沉淀完后再过滤;
(2)加入适量盐酸pH调至酸性除去的离子是CO32-和OH-,故答案为:CO32-和OH-;
(3)电解饱和食盐水制取氯气的反应为2NaCl+2H2O

2NaOH+H2↑+Cl2↑,氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O;从饱和食盐水中获得食盐晶体的方法是利用氯化钠溶解度随温度变化不大分析,用蒸发结晶方法得到;
(4)向饱和的氯化钠溶液中依次通入氨气、二氧化碳,析出碳酸氢钠晶体,加热碳酸氢钠晶体可制得纯碱,气体X为NH3,可增大饱和食盐水吸收CO2的量,有利于NaHCO3晶体的生成和析出;
(5)加热碳酸氢钠晶体可制得纯碱,反应的化学方程式为:2NaHCO3

Na2CO3+CO2↑+H2O;NaHCO3不稳定,溶解度比Na2CO3小,与盐酸反应较Na2CO3剧烈,可与NaOH反应生成Na2CO3,Na2CO3和NaHCO3都为强碱弱酸盐,溶液水解呈碱性,但Na2CO3水解程度较大,溶液碱性较强;A.NaHCO3属于盐类,纯碱是碳酸钠属于盐,故A错误;B.分别往同浓度的NaHCO3溶液和纯碱溶液中滴加稀盐酸,产生气泡的速率碳酸氢钠放出气泡比碳酸钠放出气泡快,故B错误;C.常温下在水中的溶解度,NaHCO3小于纯碱,故C错误;D.除去NaHCO3溶液中的纯碱,应往溶液中通入足量的CO2,二氧化碳和碳酸钠和水反应生成碳酸氢钠,可以除去碳酸钠;故选D。
考点:考查海水资源的利用,实验过程分析判断,反应原理的理解应用
本题所属考点:【电解池原理】
本题难易程度:【一般】
The world is a ladder for some to go up and some down. 世事如长梯,有人上来有人下.
 2NaOH+H2↑+Cl2↑,氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O;从饱和食盐水中获得食盐晶体的方法是利用氯化钠溶解度随温度变化不大分析,用蒸发结晶方法得到;
2NaOH+H2↑+Cl2↑,氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O;从饱和食盐水中获得食盐晶体的方法是利用氯化钠溶解度随温度变化不大分析,用蒸发结晶方法得到; Na2CO3+CO2↑+H2O;NaHCO3不稳定,溶解度比Na2CO3小,与盐酸反应较Na2CO3剧烈,可与NaOH反应生成Na2CO3,Na2CO3和NaHCO3都为强碱弱酸盐,溶液水解呈碱性,但Na2CO3水解程度较大,溶液碱性较强;A.NaHCO3属于盐类,纯碱是碳酸钠属于盐,故A错误;B.分别往同浓度的NaHCO3溶液和纯碱溶液中滴加稀盐酸,产生气泡的速率碳酸氢钠放出气泡比碳酸钠放出气泡快,故B错误;C.常温下在水中的溶解度,NaHCO3小于纯碱,故C错误;D.除去NaHCO3溶液中的纯碱,应往溶液中通入足量的CO2,二氧化碳和碳酸钠和水反应生成碳酸氢钠,可以除去碳酸钠;故选D。
Na2CO3+CO2↑+H2O;NaHCO3不稳定,溶解度比Na2CO3小,与盐酸反应较Na2CO3剧烈,可与NaOH反应生成Na2CO3,Na2CO3和NaHCO3都为强碱弱酸盐,溶液水解呈碱性,但Na2CO3水解程度较大,溶液碱性较强;A.NaHCO3属于盐类,纯碱是碳酸钠属于盐,故A错误;B.分别往同浓度的NaHCO3溶液和纯碱溶液中滴加稀盐酸,产生气泡的速率碳酸氢钠放出气泡比碳酸钠放出气泡快,故B错误;C.常温下在水中的溶解度,NaHCO3小于纯碱,故C错误;D.除去NaHCO3溶液中的纯碱,应往溶液中通入足量的CO2,二氧化碳和碳酸钠和水反应生成碳酸氢钠,可以除去碳酸钠;故选D。