| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
I.铝是地壳中含量最高的金属元素,其单质及其合金在生产生活中?【电解池原理】
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为3FeS2+8O2  6SO2+Fe3O4,有3 m01FeS2参加反应,转移 mol电子。 6SO2+Fe3O4,有3 m01FeS2参加反应,转移 mol电子。(2)氯化铁溶液称为化学试剂中的“多面手”,写出SO2通入氯化铁溶液中反应的离子方程式: 。 Ⅳ.锰及其化合物应用越来越广泛,MnO2是一种重要的无机功能材料,制备Mn02的方法之一是以石墨为电极,电解酸化的MnSO4溶液,阳极的电极反应式为 。现以铅蓄电池为电源电解酸化的MnS04溶液,如图所示 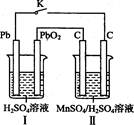 铅蓄电池的总反应方程式为 ,当蓄电池中有4 mol H+被消耗时,则电路中通过的电子的物质的量为 ,MnO2的理论产量为 g。 填空题 I.铝是地壳中含量最高的金属元素,其单质及其合金在生产生活中的应用十分广泛。 |
 6SO2+Fe3O4,有3 m01FeS2参加反应,转移 mol电子。
6SO2+Fe3O4,有3 m01FeS2参加反应,转移 mol电子。
 4Al+3O2;阴极铝离子得到电子,电极反应式为Al3++3e-=Al;阳极上生成氧气消耗电极石墨;氧化铝的熔点高,冰晶石能降低氧化铝的熔点,故答案为:Al3++3e-=Al;阳极;降低氧化铝熔点;
4Al+3O2;阴极铝离子得到电子,电极反应式为Al3++3e-=Al;阳极上生成氧气消耗电极石墨;氧化铝的熔点高,冰晶石能降低氧化铝的熔点,故答案为:Al3++3e-=Al;阳极;降低氧化铝熔点; 2NH3(g)△H=-2(b-a)kJ?mol-1,故答案为:N2(g)+3H2(g)?2NH3(g)△H=-2(b-a)kJ?mol-1;
2NH3(g)△H=-2(b-a)kJ?mol-1,故答案为:N2(g)+3H2(g)?2NH3(g)△H=-2(b-a)kJ?mol-1; 6SO2+Fe3O4,有3mol FeS2参加反应,电子转移为8×2×2=32mol,故答案为:32;
6SO2+Fe3O4,有3mol FeS2参加反应,电子转移为8×2×2=32mol,故答案为:32;本题所属考点:【电解池原理】
本题难易程度:【困难】
|
||
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | ||
| 下一篇:(14分)Li-SOCl2电池可用于心脏.. | ||