微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 (13分)Ⅰ(8分):已知Ca(OH)2与Cl2反应的氧化产物与温度有关,在一定量的石灰乳中通入足量的氯气,二者恰好完全反应。生成Cl-、ClO-、ClO3-三种含氯元素的离子,其中ClO-、ClO3-两种离子的物质的量(n)与反应时间(t)的曲线如图所示。
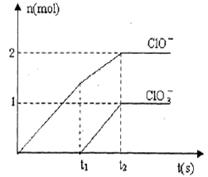
(1)t1时,开始有ClO3-生成的原因是_________________。
(2)t2时,Ca(OH)2与Cl2发生反应的总的化学方程式为 ___________________________。
(3)该石灰乳中含有Ca(OH)2的物质的量是_________mol。
(4)若反应物的量不变,在某温度下恰好完全反应时,氧化产物比值为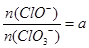 ,则n(Cl-)=____mol(用含a的代数式来表示)。
,则n(Cl-)=____mol(用含a的代数式来表示)。
Ⅱ(5分)下图中,是电解NO制备 NH4NO3,其工作原理如图所示, 为使电解产物全部转化为NH4NO3。

(1)阳极发生的电极反应式为 。
(2)需补充物质A,A是_____________,说明理由:________________。
填空题 (13分)Ⅰ(8分):已知Ca(OH)2与Cl2反应的氧化产物与温度有关,在一定量的石灰乳中通入足量的氯气,二者恰好完全反应。生成Cl-、ClO-、ClO3-三种含氯元素的离子,其中ClO-、ClO3-两种离子的物质的量(n)与反应时间(t)的曲线如图所示。

(1)t1时,开始有ClO3-生成的原因是_________________。
(2)t2时,Ca(OH)2与Cl2发生反应的总的化学方程式为 _______________ 91eXAm.org____________。
(3)该石灰乳中含有Ca(OH)2的物质的量是_________mol。
(4)若反应物的量不变,在某温度下恰好完全反应时,氧化产物比值为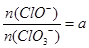 ,则n(Cl-)=____mol(用含a的代数式来表示)。
,则n(Cl-)=____mol(用含a的代数式来表示)。
Ⅱ(5分)下图中,是电解NO制备 NH4NO3,其工作原理如图所示,为使电解产物全部转化为NH4NO3。

(1)阳极发生的电极反应式为 。
(2)需补充物质A,A是_____________,说明理由:________________。
本题答案:Ⅰ、(8分)(1).反应放热使温度升高,在较高温度下可生成C
本题解析:
试题分析:I、(1)氯气与氢氧化钙在较高温度时生成氯酸根离子,t1时,开始有ClO3-生成,说明该反应放热,使温度升高,在较高温度下可生成ClO3-;
(2)t2时,Ca(OH)2与Cl2发生反应生成次氯酸根离子与氯酸根离子的物质的量分别是2mol、1mol,根据得失电子守恒,则Cl元素被还原为氯离子的物质的量是2mol+5mol=7mol,则方程式中次氯酸钙、氯酸钙、氯化钙的系数之比是2:1:7,同时产物中有水生成,配平该反应方程式,所以t2时,Ca(OH)2与Cl2发生反应的总的化学方程式为10Cl2 +10Ca(OH)2=Ca(ClO3)2+2Ca(ClO)2+7CaCl2+10H2O;
(3)根据图像判断,生成次氯酸根离子的物质的量是2mol,利用化学方程式中次氯酸钙与氢氧化钙的系数比可知,消耗的氢氧化钙的物质的量是5mol;
(4)设次氯酸根离子是amol,氯酸根离子是1mol,则Cl元素失去电子的总物质的量是amol+5mol=(a+5)mol,根据得失电子守恒,则Cl元素得到电子生成氯离子的物质的量是(a+5)mol。根据反应的化学方程式可知氯气的总物质的量是5mol,则Cl原子的物质的量是10mol,则氯离子在Cl元素中的百分比是(a+5)/(a+1+a+5)=(a+5)/(2a+6),所以n(Cl-)=10mol×a+5)/(2a+6)= (5a+25)/(a+3)mol;
II、(1)电解NO制备NH4NO3,阳极发生氧化反应,根据装置图可知NO在阳极发生氧化反应,失去电子生成硝酸根离子,所以电极反应式是NO—3e- + 2H2O ="=" NO3-+4H+;
(2)阴极NO被还原为铵根离子,电极反应式为NO+5e- + 6H+ =NH4++ H2O,根据得失电子守恒可知,阳极产生的硝酸根离子的物质的量大于阴极产生的铵根离子的物质的量,电解产生的HNO3多。总反应为8NO+7H2O=3NH4NO3+2HNO3,为使电解产物全部转化为NH4NO3,所以应补充NH3。
考点:考查氧化还原反应的分析与计算,对图像的分析,电解原理的应用
本题所属考点:【电解池原理】
本题难易程度:【困难】
Laziness in youth spells regret in old age. 少壮不努力,老大徒伤悲.