微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 (12分)工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大损害,必须进行处理,常用的处理方法有两种。
方法1:还原沉淀法
该法的工艺流程为
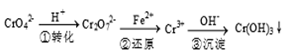
其中第①步存在下列平衡:2CrO42- (黄色) +2H+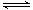 Cr2O72-(橙色) +H2O
Cr2O72-(橙色) +H2O
(1)若平衡体系的pH=2,该溶液显 色。
(2)能说明第①步反应达平衡状态的是 。
A.Cr2O72-和CrO42-的浓度相同 & #160;
B.2V(Cr2O72-)=V(CrO42-)
C.溶液的颜色不变
(3)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡
Cr(OH)3(s) 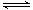 Cr3+(aq)+3OH-(aq) Ksp Cr(OH)3="c" (Cr3+)?c3(OH-)=10-32
Cr3+(aq)+3OH-(aq) Ksp Cr(OH)3="c" (Cr3+)?c3(OH-)=10-32
常温下,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至__________。
方法2电解法:
该法用Fe做电极电解含Cr2O72-的酸性废水,随着电解的进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(4)用Fe做电极的原因为 。
(5)在阴极附近溶液pH升高的原因(用电极反应式解释) ,溶液中同时生成的沉淀还有 。
填空题 (12分)工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大损害,必须进行处理,常用的处理方法有两种。
方法1:还原沉淀法
该法的工艺流程为

其中第①步存在下列平衡:2CrO42- (黄色) +2H+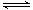 Cr2O72-(橙色) +H2O
Cr2O72-(橙色) +H2O
(1)若平衡体系的pH=2,该溶液显 色。
(2)能说明第①步反应达平衡状态的是 。
A.Cr2O72-和CrO42-的浓度相同
B.2V(Cr2O72-)=V(CrO42-)
C.溶液的颜色不变
(3)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡
Cr(OH)3(s) 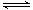 Cr3+(aq)+3OH-(aq) Ksp Cr(OH)3="c" (Cr3+)?c3(OH-)=10-32
Cr3+(aq)+3OH-(aq) Ksp Cr(OH)3="c" (Cr3+)?c3(OH-)=10-32
常温下,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至__________。
方法2电解法:
该法用Fe做电极电解含Cr2O72-的酸性废水,随着电解的进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(4)用Fe做电极的原因为 。
(5)在阴极附近溶液pH升高的原因(用电极反应式解释) ,溶液中同时生成的沉淀还有 。
本题答案:(1)橙色;(2) C;(3) 5;(4) 提供Fe2+作还
本题解析:
试题分析:(1)根据平衡移动原理:若平衡体系的pH=2,该溶液显强酸性,在酸性环境,平衡正向移动,因此溶液呈橙色;(2)A.Cr2O72-和CrO42-的浓度相同,溶液可能处于平衡状态,也可能处于非平衡状态,错误;B.在任何状态,都存在:V(Cr2O72-):V(CrO42 -)=1:2;即V(CrO42-)=2V(Cr2O72-),因此不能说明该反应处于平衡状态,错误;C.若反应未达到平衡状态,则溶液的颜色会发生改变,因此溶液的颜色不变能说明第①步反应达平衡状态,正确;(3)Ksp Cr(OH)3="c" (Cr3+)?c3(OH-)=10-32,由于c(Cr3+)= 10-5mol/L,所以c3(OH-)=10-32÷10-5=10-27。c (OH-)=10-9;由于在溶液中存在水的电离平衡,c(H+)=10-5 mol/L。所以溶液的pH=5;该法用Fe做电极电解含Cr2O72-的酸性废水,随着电解的进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。(4)用Fe做电极的原因为Fe作阳极发生氧化反应:Fe-2e-=Fe2+;Cr2O72-与Fe2+会发生氧化还原反应产生Cr3+;(5)溶液中的阳离子的放电能力:H+>Fe3+;在阴极上H+得到电子发生反应:2H++2e-=H2↑;使溶液中c(OH-)增大,所以阴极附近溶液pH升高;Fe3++3OH-= Fe(OH)3↓,所以溶液中同时生成的沉淀还有Fe(OH)3。
考点:考查化学平衡移动、反应平衡状态的判断、沉淀溶解平衡的应用、电解原理在污水处理的应用。
本题所属考点:【电解池原理】
本题难易程度:【困难】
Little goods little care. 钱财少,不烦恼.