微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 (14分)亚磷酸(H3PO3)是二元酸,H3PO3溶液存在电离平衡:H3PO3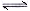 H++ H2PO3-。亚磷酸与足量NaOH溶液反应,生和Na2HPO3。
H++ H2PO3-。亚磷酸与足量NaOH溶液反应,生和Na2HPO3。
(1)①写出亚磷酸与少量NaOH溶液反应的离子方程式 。
②根据亚磷酸(H3PO3)的性质可推测Na2HPO3稀溶液的p 91ExaM.orgH 7(填“>”、“<”或“=”)。
③某温度下,0.1000 mol·L-1的H3PO3溶液中c (H+)=2.5×10-2mol·L-1,除OH—之外其他离子的浓度由大到小的顺序是 ,该温度下H3PO3电离平衡的平衡常数K= 。(H3PO3第二步电离忽略不计,结果保留两位有效数字)
(2)亚磷酸具有强还原性,可使碘水褪色,该反应的化学方程式 。
(3)电解Na2HPO3溶液也可得到亚磷酸,装置示意图如下:
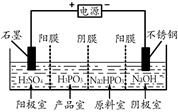
说明:阳膜只允许阳离子通过,阴膜只允许阴离子通过。
①阴极的电极反应式为 。
②产品室中生成亚磷酸的离子方程式为 。
填空题 (14分)亚磷酸(H3PO3)是二元酸,H3PO3溶液存在电离平衡:H3PO3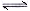 H++ H2PO3-。亚磷酸与足量NaOH溶液反应,生和Na2HPO3。
H++ H2PO3-。亚磷酸与足量NaOH溶液反应,生和Na2HPO3。
(1)①写出亚磷酸与少量NaOH溶液反应的离子方程式 。
②根据亚磷酸(H3PO3)的性质可推测Na2HPO3稀溶液的pH 7(填“>”、“<”或“=”)。
③某温度下,0.1000 mol·L-1的H3PO3溶液中c (H+)=2.5×10-2mol·L-1,除OH—之外其他离子的浓度由大到小的顺序是 ,该温度下H3PO3电离平衡的平衡常数K= 。(H3PO3第二步电离忽略不计,结果保留两位有效数字)
(2)亚磷酸具有强还原性,可使碘水褪色,该反应的化学方程式 。
(3)电解Na2HPO3溶液也可得到亚磷酸,装置示意图如下:

说明:阳膜只允许阳离子通过,阴膜只允许阴离子通过。
①阴极的电极反应式为 。
②产品室中生成亚磷酸的离子方程式为 。
本题答案:(1)①H3PO3+OH—=H2PO3—+H2O
本题解析:
试题分析:(1)①亚磷酸是二元弱 酸,与少量NaOH溶液反应生成酸式盐,反应的离子方程式为H3PO3+OH—=H2PO3—+H2O。
②亚磷酸是二元弱酸,因此相应的正盐Na2HPO3在溶液中水解溶液显碱性,则pH>7。
③亚磷酸是二元弱酸,以第一步电离为主,又因为水中还存在电离平衡,所以除OH—之外其他离子的浓度由大到小的顺序是c(H+)> c(H2PO3-)> c(HPO32-);根据H3PO3溶液存在电离平衡H3PO3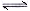 H++ H2PO3-可知,溶液中c(H2PO3-)≈c(H+)=2.5×10-2mol·L-1,c(H3PO3)=0.1000 mol·L-1-2.5×10-2mol·L-1=0.075mol/L,所以该温度下电离常数K=
H++ H2PO3-可知,溶液中c(H2PO3-)≈c(H+)=2.5×10-2mol·L-1,c(H3PO3)=0.1000 mol·L-1-2.5×10-2mol·L-1=0.075mol/L,所以该温度下电离常数K=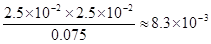 。
。
(2)亚磷酸具有强还原性,可使碘水褪色,在反应中被氧化为磷酸,反应的化学方程式为H3PO3+ I2+H2O = 2HI+ H3PO4。
(3)①电解池中阴极得到电子,因此阴极是溶液中的氢离子放电,电极反应式为2H++ 2e-=H2↑。
②阳极氢氧根离子放电,同时产生氢离子,氢离子进入产品室与Na2HPO3反应得到亚磷酸,所以在产品室生成亚磷酸的方程式为HPO32-+ 2H+=H3PO3。
考点:考查弱电解质的电离、离子浓度大小比较、氧化还原反应以及电化学原理的应用
本题所属考点:【电解池原理】
本题难易程度:【困难】
Old friends and old wine are best. 陈酒味醇,老友情深.