微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 (10分)铜及其化合物在工来源:91考试网 91EXAm.org农业生产及日常生活中应用非常广泛。
(1)由辉铜矿制取铜的反应过程为:
2Cu2S(s) + 3O2 (g) = 2Cu2O(s) + 2SO2(g) △H=-768.2kJ·mol-1,
2Cu2O(s) + Cu2S(s) =" 6Cu(s)" + SO2(g) △H=+116.0kJ·mol-1,
请写出Cu2S与O2反应生成Cu与SO2的热反应方程式: 。
(2)氯化铜溶液中铜各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与c(Cl-) 的关系如图。

①当c(Cl-)="9" mol·L-1时,溶液中主要的3种含铜物种浓度大小关系为 。
②在c(Cl-)="1" mol·L-1的氯化铜溶液中,滴入AgNO3溶液,含铜物种间转化的离子方程式为 (任写一个)。
(3) 电解Na2HPO3溶液可得到亚磷酸,装置如下图(说明:阳膜只允许阳离子通过,阴膜只允许阴离子通过)
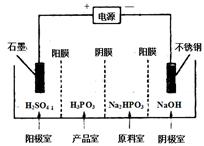
①阳极的电极反应式为: ____________。
②产品室中反应的离子方程式为: _____。
填空题 (10分)铜及其化合物在工农业生产及日常生活中应用非常广泛。
(1)由辉铜矿制取铜的反应过程为:
2Cu2S(s) + 3O2 (g) = 2Cu2O(s) + 2SO2(g) △H=-768.2kJ·mol-1,
2Cu2O(s) + Cu2S(s) =" 6Cu(s)" + SO2(g) △H=+116.0kJ·mol-1,
请写出Cu2S与O2反应生成Cu与SO2的热反应方程式: 。
(2)氯化铜溶液中铜各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与c(Cl-) 的关系如图。

①当c(Cl-)="9" mol·L-1时,溶液中主要的3种含铜物种浓度大小关系为 。
②在c(Cl-)="1" mol·L-1的氯化铜溶液中,滴入AgNO3溶液,含铜物种间转化的离子方程式为 (任写一个)。
(3) 电解Na2HPO3溶液可得到亚磷酸,装置如下图(说明:阳膜只允许阳离子通过,阴膜只允许阴离子通过)

①阳极的电极反应式为: ____________。
②产品室中反应的离子方程式为: _____。
本题答案:(10分)(1)Cu2S(s)+O2(g)=2Cu(s)+S
本题解析:
试题分析:(1)已知:①2Cu2S(s) + 3O2 (g)= 2Cu2O(s) + 2SO2(g) △H=—768.2kJ·mol-1,②2Cu2O(s) + Cu2S(s)=6Cu(s) + SO2(g) △H=+116.0kJ·mol-1,则根据盖斯定律可知(①+②)÷3即得到Cu2S与O2反应生成Cu与SO2的热反应方程式)Cu2S(s)+O2(g)=2Cu(s)+SO2(g) △H = -217.4KJ/mol。
(2)①根据图像可知当c(Cl-)="9" mol·L-1时,溶液中主要的3种含铜物种浓度大小关系为c(CuCl2)>c(CuCl+)>c(CuCl3-);
②在c(Cl-)=1 mol·L-1的氯化铜溶液中,滴入AgNO3溶液,由于氯离子易与银 离子结合生成氯化银沉淀,则根据图像可知含铜物种间转化的离子方程式可以是CuCl+ + Ag+ =" AgCl↓+" Cu2+或CuCl2 + Ag+ = CuCl+ + AgCl↓或CuCl2 + 2Ag+ = Cu2+ + 2AgCl↓。
(3)①电解池中阳极失去电子发生氧化反应,则根据装置可知阳极是溶液中的氢氧根放电,电极反应式为4OH--4e-=2H2O+O2↑;
②阳极氢氧根放电因此溶液氢离子浓度增大,则通过阳离子交换膜进入产品室,则产品室中反应的离子方程式为HPO32-+2H+=H3PO3。
考点:考查盖斯定律、氯化铜溶液的有关分析与判断以及电化学原理的应用
本题所属考点:【电解池原理】
本题难易程度:【困难】
Beggars cannot be choosers. 乞丐不能挑肥拣瘦.