微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 (16分)
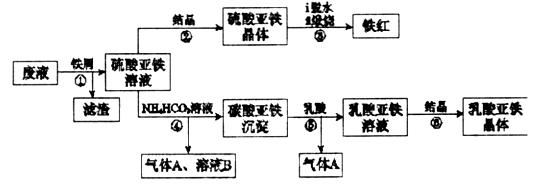
某工厂对工业生产钛白粉产生的废液进行综合利用,废液中含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4,可用于生产颜料铁红和补血剂乳酸亚铁。其生产工艺流程如下:
已知:①TiOSO4可溶于水,在水中可以电离为Ti02+和SO4 :
:
②TiOSO4水解的反应为: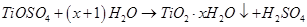
请回答:
(1)步骤①所得滤渣 的主要成分为______________________________。
(2)步骤③硫酸亚铁在空气中煅烧生成铁红和三氧化硫,该反应中氧化剂和还原剂的物质的量之比为__________________。
(3)步骤④需控制反应温度低于35℃,其目的是___________________。
(4)步骤④反应的离子方程式是__________________________________。
(5)已知: ,试用平衡移动原理解释步骤⑤生成乳酸亚铁的原因_________________________________________________________。
,试用平衡移动原理解释步骤⑤生成乳酸亚铁的原因_________________________________________________________。
(6)溶液B常被用于电解生产(NH4)2S208(过二硫酸铵)。电解时均用惰性电极,阳极发生的电极反应可表示为_____________________________________。
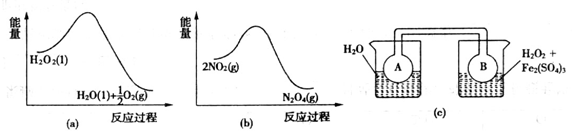
(7)Fe3+对H2O2的分解具有催化作用。利用下图(a)和(b)中的信息,按图(c)装置(连通的A、B瓶中已充有NO2气体)进行实验。可观察到B瓶中气体颜色比A瓶中的_________(填“深”或“浅”),其原因是_________________________________。
填空题 (16分)
某工厂对工业生产钛白粉产生的废液进行综合利用,废液中含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4,可用于生产颜料铁红和补血剂乳酸亚铁。其生产工艺流程如下:

已知:①TiOSO4可溶于水,在水中可以电离为Ti02+和SO4 :
:
②TiOSO4水解的反应为: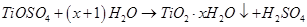
请回答:
(1)步骤①所得滤渣的主要成分为______________________________。
(2)步骤③硫酸亚铁在空气中煅烧生成铁红和三氧化硫,该反应中氧化剂和还原剂的物质的量之比为__________________。
(3)步骤④需控制反应温度低于35℃,其目的是___________________。
(4)步骤④反应的离子方程式是__________________________________。
(5)已知: ,试用平衡移动原理解释步骤⑤生成乳酸亚铁的原因_________________________________________________________。
,试用平衡移动原理解释步骤⑤生成乳酸亚铁的原因_________________________________________________________。
(6)溶液B常被用于电解生产(NH4)2S208(过二硫酸铵)。电解时均用惰性电极,阳极发生的电极反应可表示为_____________________________________。
(7)Fe3+对H2O2的分解具有催化作用。利用下图(a)和(b)中的信息,按图(c)装置(连通的A、B瓶中已充有NO2气体)进行实验。可观察到B瓶中气体颜色比A瓶中的_________(填“深”或“浅”),其原因是_________________________________。

本题答案:(16分)[来源:学+科+网Z+X+X+K]
(1)T
本题解析:
试题分析:(1)废液中大量H2SO4和少量Fe2(SO4)3与过量Fe反应生成硫酸亚铁,TiOSO4水解的反应为:TiOSO4+(x+1) H2O =TiO2·xH2O↓+H2 SO4,所 以滤渣A的成分是TiO2?xH2O、Fe;
(2)硫酸亚铁在空气中煅烧生成铁红和三氧化硫,发生反应的化学方程式是4FeSO4+O2 2Fe2O3+4SO3,在该反应中氧化剂是氧气,还原剂是硫酸亚铁,所以氧化剂与还原剂的物质的量之比是1:4;
2Fe2O3+4SO3,在该反应中氧化剂是氧气,还原剂是硫酸亚铁,所以氧化剂与还原剂的物质的量之比是1:4;
(3)步骤④中加入碳酸氢铵,使亚铁离子沉淀,若温度太高则碳酸氢铵易分解,所以需控制反应温度低于35℃;
(4)根据流程图可知,碳酸氢铵与硫酸亚铁反应生成碳酸亚铁沉淀和二氧化碳气体、水及硫酸铵,所以离子方程式是Fe2+ + 2HCO3一="=" FeCO3 ↓+ H2O + CO2↑;
(5)步骤⑤中加入乳酸,与碳酸根离子反应生成二氧化碳和水,使碳酸亚铁的溶解平衡正向移动,所以碳酸亚铁逐渐转化为乳酸亚铁溶液,
(6)溶液B是硫酸铵溶液,常被用于电解生产(NH4)2S208(过二硫酸铵),电解时阳极发生氧化反应,元素的化合价升高,根据化学式中正负化合价代数和为0的原则偏大(NH4)2S208中S元素的化合价平均为+7价,则S元素的化合价从+6价升高到+7价,所以阳极是硫酸根离子失去电子,生成(NH4)2S208,电极反应式是2SO42--2e-==S2O82-;
(7)由a图可知,过氧化氢分解为水和氧气的反应是放热反应,所以B瓶的温度高于A瓶;由b图可知,二氧化氮转化为四氧化二氮的反应是放热反应,温度升高,平衡向生成二氧化氮的方向移动,所以B瓶的颜色比A瓶深。
考点:考查对工艺流程的分析判断,氧化还原反应的分析,电化学反应原理的应用,化学平衡的移动
本题所属考点:【电解池原理】
本题难易程度:【困难】
A diligent scholar, and the master's paid. 学生勤奋学习,就是对老师的报答.