微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
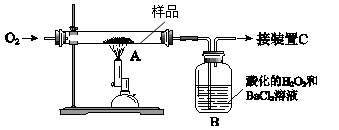
实验题 21.(10分)某中药主要含二硫化亚铁(FeS2),某学习小组欲用下图所示装置进行实验,测定其铁、硫元素的质量分数。
(1)装置中,A为高温灼烧装置,B为气体吸收装置,C为检测尾气中是否含有SO2的传感器。取m g该中药样品于装置A中,经充分反应,使硫元素全部转化为SO2和SO3,在B中得到白色沉淀,传感器(装置C)未检测到SO2。
① 装置B中的H2O2反应时表现出了 性。
② 欲计算硫元素的质量分数,需测量的数据是 。
③ 传感器的工作原理如下图所示。

传感器中阴极的电极反应式是 。
(2)为测定铁元素的质量分数,继续实验。
a .将A装置中的剩余固体用足量盐酸酸浸,有少量H2产生。充分反应后过滤,得到黄色滤液;
b.向滤液中滴加TiCl3溶液,至恰好完全反应,TiCl3被氧化为TiO2+;
c.用滴定法测定Fe2+的量,消耗v mL n mol/LK2Cr2O7溶液。
① a中滤液含有的金属阳离子是 。
② b中反应的离子方程式是 。
③ c中K2Cr2O7被还原为Cr3+,样品中铁元素质量分数的数学表示式是 。
实验题 21.(10分)某中药主要含二硫化亚铁(FeS2),某学习小组欲用下图所示装置进行实验,测定其铁、硫元素的质量分数。
(1)装置中,A为高温灼烧装置,B为气体吸收装置,C为检测尾气中是否含有SO2的传感器。取m g该中药样品于装置A中,经充分反应,使硫元素全部转化为SO2和SO3,在B中得到白色沉淀,传感器(装置C)未检测到SO2。

① 装置B中的H2O2反应时表现出了 性。
② 欲计算硫元素的质量分数,需测量的数据是 。
③ 传感器的工作原理如下图所示。

传感器中阴极的电极反应式是 。
(2)为测定铁元素的质量分数,继续实验。
a.将A装置中的剩余固体用足量盐酸酸浸,有少量H2产生。充分反应后过滤,得到黄色滤液;
b.向滤液中滴加TiCl3溶液,至恰好完全反应,TiCl3被氧化为TiO2+;
c.用滴定法测定Fe2+的量,消耗v mL n mol/LK2Cr2O7溶液。
① a中滤液含有的金属阳离子是 。
② b中反应的离子方程式是 。
③ c中K2Cr2O7被还原为Cr3+,样品中铁元素质量分数的数学表示式是 。
本题答案:(1)① 氧化性 ② B中沉淀的质量
③ 2
本题解析:
试题分析:(1)①取中药样品于装置A中,经充分反应,硫元素全部转化为SO2和SO3,将物质转移入酸化的H2O2和氯化钡溶液中,产生了白色沉淀,该白色沉淀为硫酸钡,在这个过程中H2O2将+4价的S全部氧化为+6价的S,最终全部变为硫酸钡,故H2O2表现的是氧化性;②要计算硫元素的质量分数,需测量B中产生的白色沉淀硫酸钡的质量,根据质量确定硫元素的质量分数;③ 根据传感器的工作原理可知阴极电解质溶液得电子,HSO3-得电子后转变为S2O42-,电极方程式为2HSO3-+2H++2e-= S2O42-+2H2O;(2)a项将A装置中的剩余固体用足量盐酸酸浸,有少量H2产生。充分反应后过滤,得到黄色滤液,说明溶液中除了存在Fe2+外,还存在着Fe3+;b项向滤液中滴加TiCl3溶液,至恰好完全反应,TiCl3被氧化为TiO2+,离子方程式为FeCl3 + TiCl3+H2O= FeCl2+TiO Cl2+2H Cl,离子方程式为Fe3+ + Ti3+ +H2O= Fe2++TiO2+ +2H+;c项用滴定法测定Fe2+的量,K2Cr2O7被还原为Cr3+,发生的化学反应方程式为:6FeSO4+K2Cr2O7+7H2SO4=3Fe2(SO4)3+K2SO4+Cr2(SO4)3+7H2O,离子方程式为6Fe2+ + Cr2O72- +14H+ =6Fe3+ +2Cr3+ +7H2O,消耗v mL n mol/LK2Cr2O7溶液则有n(Cr2O72-)=nv×10-3mol,根据方程式计算可得n(Fe)=nv×10-3×6mol,那么m(Fe)= nv×10-3×6×56g/mol="0.336" nvg,则铁元素质量分数的数学表示式为ω= =
=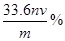
考点:元素性质及基本计算
点评:本题主要考察了元素及其化合物的相关性质和计算,考察内容较多,涉及了化学反应方程式的书写以及二价铁的滴定,本题的关键是确定二价铁和三价铁之间的相互转化。
本题所属考点:【电解池原理】
本题难易程度:【困难】
Do not pick the sesame seeds but overlook the watermelons. 勿拣了芝麻,丢了西瓜。