微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 ; (10分)(1)盐碱地(含较多NaCl、Na2CO3)不利于作物生长,通过施加适量石膏(CaSO4·2H2O)可以降低土壤的碱性。试用化学方程式表示用石膏降低土壤碱性的反应原理________。
(2)习惯上把电解饱和食盐水的工业生产叫做氯碱工业,用化学方程式表示电解饱和食盐水的总反应为________________________。
(3)为了除去MgCl2酸性溶液中的Fe3+,可在加热搅拌的条件下加入一种试剂,过滤后,再向滤液中加入适量的盐酸,这种试剂是_____________。(填写化学式,只填一种即可)
(4)通过火法冶金炼出的铜是粗铜,不适于电器及其他许多工业使用,必须进行电解精炼。电解时,用________作阴极,________作阳极。
填空题 (10分)(1)盐碱地(含较多NaCl、Na2CO3)不利于作物生长,通过施加适量石膏(CaSO4·2H2O)可以降低土壤的碱性。试用化学方程式表示用石膏降低土壤碱性的反应原理________。
(2)习惯上把电解饱和食盐水的工业生产叫做氯碱工业,用化学方程式表示电解饱和食盐水的总反应为________________________。
(3)为了除去MgCl2酸性溶液中的Fe3+,可在加热搅拌的条件下加入一种试剂,过滤后,再向滤液中加入适量的盐酸,这种试剂是_____________。(填写化学式,只填一种即可)
(4)通过火法冶金炼出的铜是粗铜,不适于电器及其他许多工业使用,必须进行电解精炼。电解时,用________作阴极,________作阳极。
本题答案:(1)Na2CO3 + CaSO4=CaCO3 + Na2S
本题解析:
试题分析:(1)土壤的碱性主要是Na2CO3水解引起的,加入适量的石膏发生:Na2CO3 + CaSO4 =CaCO3 + Na2SO4,减少了CO32-,可以可以减低碱性。(2)电解饱和食盐水的总反应为2NaCl + 2H2O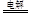 2NaOH+Cl2↑+H2↑(3)为了除去MgCl2酸性溶液中的Fe3+,向溶液中加入试剂使Fe3+转化为沉淀而除去,为不引入新的杂质,应该加入MgO或Mg(OH)2。(4)铜的精炼是要用纯铜作阴极,粗铜做阳极,通电时纯铜不放电,粗铜在阳极放电,生成铜离子。
2NaOH+Cl2↑+H2↑(3)为了除去MgCl2酸性溶液中的Fe3+,向溶液中加入试剂使Fe3+转化为沉淀而除去,为不引入新的杂质,应该加入MgO或Mg(OH)2。(4)铜的精炼是要用纯铜作阴极,粗铜做阳极,通电时纯铜不放电,粗铜在阳极放电,生成铜离子。
考点:沉淀的转化,电解中氯碱工业、金属的冶炼的基本知识。
本题所属考点:【电解池原理】
本题难易程度:【一般】
Love victory, but despise the pride of triumph. 要爱胜利,但不要为胜利而骄傲。