微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 (14分)目前正在研究和已经使用的储氢合金有镁系合金、稀土系合金等。
(1)已知:Mg(s)+H2(g)=MgH2(s) △H1=-74.5 kJ·mol-1
Mg2Ni(s)+2H2(g)=Mg2NiH4(s) △H2 =-64.4 kJ·mol-1
Mg2Ni(s)+2MgH2(s)=2Mg(s)+ Mg2NiH4(s) △H3,则△H3 = kJ·mol-1。
(2)工业上用电解熔融的无水氯化镁获得镁。其中氯化镁晶体脱水是关键工艺之一,一种氯化镁晶体脱水的方法是:先将MgCl2·6H2O转化为MgCl2·NH4C1·nNH3(铵镁复盐),然后在700℃脱氨得到无水氯化镁,脱氨反应的化学方程式为 。
(3)储氢材料Mg(AlH4)2在110~200℃的反应为:Mg(AlH4)2=MgH2+2Al+3H2↑。生成2.7gAl时,产生的H2在标准状况下的体积为 L。
(4)采用球磨法制备Al与LiBH4的复合材料,并对Al-LiBH4体系与水反应产氢的特性进行下列研究:
①下图为25℃水浴时每克不同配比的Al-LiBH4复合材料与水反应产生H2体积随时间变化关系图。由下图可知,下列说法正确的是 (填字母)。
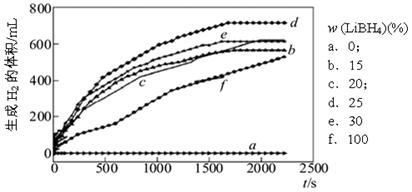
a.25℃时,纯铝与水不反应
b.25℃时,纯LiBH4与水反应产生氢气
c.25℃时,Al-LiBH4复合材料中LiBH4含量越高,1000s内产生氢气的体积越大
②下图为25℃和75℃时,Al-LiBH4复合材料[ w (LiBH4)=25%]与水反应一定时间后产物的X-射线衍射图谱(X-射线衍射可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。
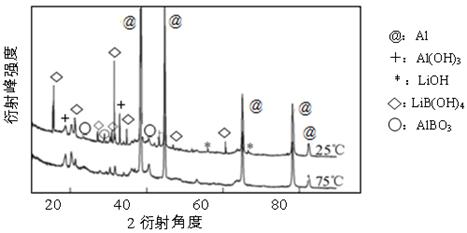
从图中可知,25℃时Al-LiBH4复合材料中与水完全反应的物质是 (填化学式)。
(5)储氢还可借助有机物,如利用环己烷和苯之间的可逆反应来实现脱氢和加氢:
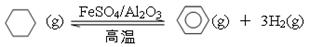
①某温度下,向恒容密闭容器中加入环己烷,起始浓度为a mol·L-1,平衡时苯的浓度为b mol·L-1,该反应的平衡常数K= 。
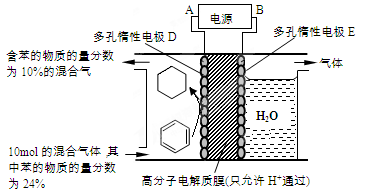
②一定条件下,下图装置可实现有机物的电化学储氢(忽略其它有机物)。生成目标产物的电极反应式为 。
填空题 (14分)目前正在研究和已经使用的储氢合金有镁系合金、稀土系合金等。
(1)已知:Mg(s)+H2(g)=MgH2(s) △H1=-74.5 kJ·mol-1
Mg2Ni(s)+2H2(g)=Mg2NiH4(s) △H2 =-64.4 kJ·mol-1
Mg2Ni(s)+2MgH2(s)=2Mg(s)+ Mg2NiH4(s) △H3,则△H3 = kJ·mol-1。
(2)工业上用电解熔融的无水氯化镁获得镁。其中氯化镁晶体脱水是关键工艺之一,一种氯化镁晶体脱水的方法是:先将MgCl2·6H2O转化为MgCl2·NH4C1·nNH3(铵镁复盐),然后在700℃脱氨得到无水氯化镁,脱氨反应的化学方程式为 。
(3)储氢材料Mg(AlH4)2在110~200℃的反应为:Mg(AlH4)2=MgH2+2Al+3H2↑。生成2.7gAl时,产生的H2在标准状况下的体积为 L。
(4)采用球磨法制备Al与LiBH4的复合材料,并对Al-LiBH4体系与水反应产氢的特性进行下列研究:
①下图为25℃水浴时每克不同配比的Al-LiBH4复合材料与水反应产生H2体积随时间变化关系图。由下图可知,下列说法正确的是 (填字母)。

a.25℃时,纯铝与水不反应
b.25℃时,纯LiBH4与水反应产生氢气
c.25℃时,Al-LiBH4复合材料中LiBH4含量越高,1000s内产生氢气的体积越大
②下图为25℃和75℃时,Al-LiBH4复合材料[w (LiBH4)=25%]与水反应一定时间后产物的X-射线衍射图谱(X-射线衍射可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。

从图中可知,25℃时Al-LiBH4复合材料中与水完全反应的物质是 (填化学式)。
(5)储氢还可借助有机物,如利用环己烷和苯之间的可逆反应来实现脱氢和加氢:
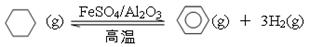
①某温度下,向恒容密闭容器中加入环己烷,起始浓度为a mol·L-1,平衡时苯的浓度为b mol·L-1,该反应的平衡常数K= 。
②一定条件下,下图装置可实现有机物的电化学储氢(忽略其它有机物)。生成目标产物的电极反应式为 。

本题答案:(1)84.6 (2分)(2)MgCl2·NH4C
本题解析:
试题分析:(1)已知:①Mg(s)+H2(g)=MgH2(s) △H1=-74.5 kJ·mol-1,②Mg2Ni(s)+2H2(g)=Mg2NiH4(s) △H2 =-64.4 kJ·mol-1,则根据盖斯定律可知②—①×2即得到热化学方程式Mg2Ni(s)+2MgH2(s)=2Mg(s)+ Mg2NiH4(s) △H3=+84.6kJ·mol-1。
(2)氯化铵受热易分解,则脱氨反应的化学方程式为MgCl2·NH4C1·nNH3 700℃ MgCl2+HC1↑+(n +1)NH3↑。
(3)2.7g铝的物质的量是2.7g÷27g/mol=0.1mol,则根据方程式Mg(AlH4)2=MgH2+2Al+3H2↑可知生成0.15mol氢气,所以产生的H2在标准状况下的体积为0.15mol×22.4L/mol=3.36L。
(4)①a.根据图像可知当LiBH4含量为0时,产生的氢气体积为0,这说明25℃时,纯铝与水不反应,a正确;b.随着LiBH4含量的增加,产生的氢气开始增加,这说明25℃时,纯LiBH4与水反应产生氢气,b正确;c.根据图像可知当LiBH4含量是25%时,产生的氢气最多,这说明25℃时,Al-LiBH4复合材料中LiBH4含量越高,1000s www.91eXam.org内产生氢气的体积不一定越大,c错误,答案选ab。
②从图中可知,25℃时已经没有LiBH4,这说明Al-LiBH4复合材料中与水完全反应的物质是LiBH4。
(5)储氢还可借助有机物,如利用环己烷和苯之间的可逆反应来实现脱氢和加氢:
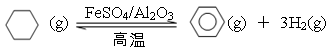
①某温度下,向恒容密闭容器中加入环己烷,起始浓度为a mol·L-1,平衡时苯的浓度为b mol·L-1,则根据方程式可知产生氢气的浓度是3b mol·L-1,消耗环己烷的浓度是b mol·L-1,,剩余环己烷的浓度是(a—b)mol·L-1。又因为化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,因此该反应的平衡常数K=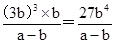 。
。
②一定条件下,下图装置可实现有机物的电化学储氢(忽略其它有机物),这说明应该是苯吸收氢气转化为环己烷,则生成目标产物的电极反应式为C6H6+6H++6e—=C6H12。
考点:考查盖斯定律应用、物质的量的有关计算、物质制备分析与应用、平衡常数计算以及电化学应用等
本题所属考点:【电解池原理】
本题难易程度:【困难】
Fire is the test of gold, adversity of friendship. 烈火试真金,苦难试友情.