微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 (15分)甲醇是一种可再生能源,又是一种重要的化工原料,具有开发和应用的广阔前景。工业上可用如下方法合成甲醇:
方法一
| CO(g) +2H2(g)  CH3OH(g) CH3OH(g)
|
方法二
| CO2(g) +3H2(g)  CH3OH(g) H2O(g) CH3OH(g) H2O(g)
|
(1)已知:① 2CH3OH(l) + 3O2(g)  2CO2(g) + 4H2O(g) △H=-1275.6 kJ?mol-1
2CO2(g) + 4H2O(g) △H=-1275.6 kJ?mol-1
② 2CO(g) + O2(g)  2CO2(g) △H=-566.0 kJ?mol-1
2CO2(g) △H=-566.0 kJ?mol-1
③ H2O(l) = H2O(g) △H =" +" 44.0 kJ?mol-1
则甲醇不完全燃烧生成CO和液态水的热化学反应方程式为 。
(2)方法一生产甲醇是目前工业上常用的方法。在一定温度下,向2L密闭容器中充入1molCO和2molH2,发生上述反应,5分钟反应达平衡,此时CO的转化率为80%。请回答下列问题:
①前5分钟内甲醇的平均反应速率为 ;已知该反应在低温下能自发进行,则反应的
△H为 (填“>”、“<”或 “=”)0。
②在该温度下反应的平衡常数K= 。
③某时刻向该平衡体系中加入CO、H2、CH3OH各0.2mol后,将使ν正 ν逆(填“>”“=”“<”)。
(3)全钒液流储能电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如下图所示。
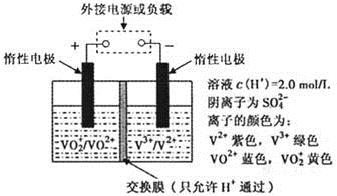
①当左槽溶液逐渐由黄变蓝,其电极反应式为 91ExAm.org 。
②充电过程中,右槽溶液颜色变化是 。
③若用甲醇燃料电池作为电源对其充电时,若消耗甲醇4.8g时,电路中转移的电量的为 (法拉第常数F=9.65×l04C · mol-1)。
填空题 (15分)甲醇是一种可再生能源,又是一种重要的化工原料,具有开发和应用的广阔前景。工业上可用如下方法合成甲醇:
方法一
| CO(g) +2H2(g)  CH3OH(g) CH3OH(g)
|
方法二
| CO2(g) +3H2(g)  CH3OH(g) H2O(g) CH3OH(g) H2O(g)
|
(1)已知:① 2CH3OH(l) + 3O2(g)  2CO2(g) + 4H2O(g) △H=-1275.6 kJ?mol-1
2CO2(g) + 4H2O(g) △H=-1275.6 kJ?mol-1
② 2CO(g) + O2(g)  2CO2(g) △H=-566.0 kJ?mol-1
2CO2(g) △H=-566.0 kJ?mol-1
③ H2O(l) = H2O(g) △H =" +" 44.0 kJ?mol-1
则甲醇不完全燃烧生成CO和液态水的热化学反应方程式为 。
(2)方法一生产甲醇是目前工业上常用的方法。在一定温度下,向2L密闭容器中充入1molCO和2molH2,发生上述反应,5分钟反应达平衡,此时CO的转化率为80%。请回答下列问题:
①前5分钟内甲醇的平均反应速率为 ;已知该反应在低温下能自发进行,则反应的
△H为 (填“>”、“<”或 “=”)0。
②在该温度下反应的平衡常数K= 。
③某时刻向该平衡体系中加入CO、H2、CH3OH各0.2mol后,将使ν正 ν逆(填“>”“=”“<”)。
(3)全钒液流储能电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如下图所示。

①当左槽溶液逐渐由黄变蓝,其电极反应式为 。
②充电过程中,右槽溶液颜色变化是 。
③若用甲醇燃料电池作为电源对其充电时,若消耗甲醇4.8g时,电路中转移的电量的为 (法拉第常数F=9.65×l04C · mol-1)。
本题答案:(1)CH3OH(l) + O2(g)=CO(g) + 2H
本题解析:
试题分析:(1)已知:① 2CH3OH(l) + 3O2(g) 2CO2(g) + 4H2O(g) △H=-1275.6 kJ?mol-1,② 2CO(g) + O2(g)
2CO2(g) + 4H2O(g) △H=-1275.6 kJ?mol-1,② 2CO(g) + O2(g) 2CO2(g) △H=-566.0 kJ?mol-1,③H2O(l)=H2O(g) △H =" +" 44.0 kJ?mol-1,则根据盖斯定律可知(①—②—③×4)÷2即得到甲醇不完全燃烧生成CO和液态水的热化学反应方程式CH3OH(l) + O2(g)=CO(g) + 2H2O(l) △H=-442.8kJ?mol-1。
2CO2(g) △H=-566.0 kJ?mol-1,③H2O(l)=H2O(g) △H =" +" 44.0 kJ?mol-1,则根据盖斯定律可知(①—②—③×4)÷2即得到甲醇不完全燃烧生成CO和液态水的热化学反应方程式CH3OH(l) + O2(g)=CO(g) + 2H2O(l) △H=-442.8kJ?mol-1。
(2)①5分钟反应达平衡,此时CO的转化率为80%,则消耗CO是0.8mol,根据方程式CO(g) +2H2(g) CH3OH(g)可知生成甲醇是0.8mol,浓度是0.4mol/L,因此前5分钟内甲醇的平均反应速率为0.4mol/L÷5min=0.08mol/(L?min);已知该反应在低温下能自发进行,由于正方应是体积减小的,即△S<0,则根据△G=△H—T·△S可知,该反应为放热反应,即△H<0。
CH3OH(g)可知生成甲醇是0.8mol,浓度是0.4mol/L,因此前5分钟内甲醇的平均反应速率为0.4mol/L÷5min=0.08mol/(L?min);已知该反应在低温下能自发进行,由于正方应是体积减小的,即△S<0,则根据△G=△H—T·△S可知,该反应为放热反应,即△H<0。
②消耗CO是0.8mol,则平衡时氢气和CO的物质的量分别是0.4mol和0.2mol,浓度分别是0.2mol/L和0.1mol/L,化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,则在该温度下反应的平衡常数K=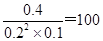 。
。
③某时刻向该平衡体系中加入CO、H2、CH3OH各0.2mol后,瞬间CO、氢气和甲醇的浓度分别变为0.2mol/L、0.3mol/L、0.5mol/L,则此时浓度商= <100,因此平衡向正反应方向进行,所以将使ν正>ν逆。
<100,因此平衡向正反应方向进行,所以将使ν正>ν逆。
(3)①当左槽溶液逐渐由黄变蓝,说明VO2+转化为VO2+,即V元素的化合价从+3价升高到+4价,则其电极反应式为VO2+—e—+2H+=VO2++H2O。
②充电过程中,右槽中电极与电源负极相连,作阴极V3+得到电子转化为V2+,因此溶液颜色变化是由绿色变为紫色。
③4.8g甲醇的物质的量是4.8g÷32g/mol=0.15mol,在反应中失去0.15mol×6=0.9mol电子,所以电路中转移的电量的为9.65×l04C·mol-1×0.9mol=8.685×104C。
考点:考查盖斯定律的应用、平衡状态计算、反应自发性以及电化学原理的应用
本题所属考点:【电解池原理】
本题难易程度:【困难】
Judge not a book by its covers. 评价书不能看封面。