微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
简答题 (14分)甲醇是一种重要的化工原料,在生产中有着重要的应用。工业上用甲烷氧化法合成甲醇的反应有:

(1)用CH4和02直接制备甲醇蒸气的热化学方程式为 &# 160; 。
(2)某温度下,向4 L恒容密闭容器中通人6 mol C02和6mol CH4,发生反应(i),平衡体系中各组分的体积分数均为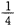 ,则此温度下该反应的平衡常数K= ,CH4的转化率为 。
,则此温度下该反应的平衡常数K= ,CH4的转化率为 。
(3)工业上可通过甲醇羰基化法制取甲酸甲酯,其反应的热化学方程式为:
 ,科研人员对该反应进行了研究,部分研究结果如下:
,科研人员对该反应进行了研究,部分研究结果如下:


①从反应压强对甲醇转化率的影响“效率”看,工业制取甲酸甲酯应选择的压强是 (填“3.5× 106 Pa” “4.O×106 Pa”或“5.0× 106 Pa”)。
②实际工业生产中采用的温度是80℃,其理由是 。
(4)直接甲醇燃料电池(简称DMFC)由于其结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注。DMFC的工作原理如图所示:

①通入a气体的电极是电池的 (填“正”或“负”)极,其电极反应式为 .
②常温下,用此电池以惰性电极电解O.5 L饱和食盐水(足量),若两极共生成气体1.12 L(已折算为标准状况下的体积),则电解后溶液的pH为 (忽略溶液的体积变化)。
简答题 (14分)甲醇是一种重要的化工原料,在生产中有着重要的应用。工业上用甲烷氧化法合成甲醇的反应有:

(1)用CH4和02直接制备甲醇蒸气的热化学方程式为 。
(2)某温度下,向4 L恒容密闭容器中通人6 mol C02和6mol CH4,发生反应(i),平衡体系中各组分的体积分数均为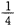 ,则此温度下该反应的平衡常数K= ,CH4的转化率为 。
,则此温度下该反应的平衡常数K= ,CH4的转化率为 。
(3)工业上可通过甲醇羰基化法制取甲酸甲酯,其反应的热化学方程式为:
 ,科研人员对该反应进行了研究,部分研究结果如下: 91EXAM.org
,科研人员对该反应进行了研究,部分研究结果如下: 91EXAM.org


①从反应压强对甲醇转化率的影响“效率”看,工业制取甲酸甲酯应选择的压强是 (填“3.5× 106 Pa” “4.O×106 Pa”或“5.0× 106 Pa”)。
②实际工业生产中采用的温度是80℃,其理由是 。
(4)直接甲醇燃料电池(简称DMFC)由于其结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注。DMFC的工作原理如图所示:

①通入a气体的电极是电池的 (填“正”或“负”)极,其电极反应式为 .
②常温下,用此电池以惰性电极电解O.5 L饱和食盐水(足量),若两极共生成气体1.12 L(已折算为标准状况下的体积),则电解后溶液的pH为 (忽略溶液的体积变化)。
本题答案:(1)2CH4(g)+02(g)?2CH3OH(g)△H=-
本题解析:
试题分析:(1)由盖斯定律知(i)×2+(ii)×2+(iii)得2CH4(g)+02(g)?2CH3OH(g)其△H=(+247.3kJ/mol)×2+(-90.1 kJ/mol)×2+(-566.0 kJ/mol)="-251.6" kJ/mol(2)利用三行式:设反应消耗CH4物质的量为n
CH4(g)+C02(g)?2CO(g)+2H2(g)
起始n/mol 6 6 0 0
变化n/mol n n 2n 2n
平衡n/mol 6-n 6-n 2n 2n
由题意得:2n/(12+2n)="1/4" 解得n=2mol
K=(12×12)/(1×1)=1
CO转化率为(2/6)×100%=33.3%(3)①由图可知, 3.5× 106 Pa 到4.O×106 Pa 之间甲醇转化率提高最明显,且4.0×106Pa时甲醇转化率已经较高,故工业制取甲酸甲酯选择的压强为4.0×106Pa。②图像中80℃时速率大且高于80℃时速率变化不明显,又因为该反应为放热反应升温不利反应正向进行,所以实际采用的温度是80℃。(4)①由DMFC的工作原理图示,根据电子流动方向判断a为负极通入的为甲醇。电极反应方程式为:CH3OH-6e-+2H2O=CO2+6H+②惰性电极电解O.5 L饱和食盐水,两极共生成气体0.05mol即氢气、氯气各0.025mol由反应2Cl-+2H2O=Cl2↑+H2↑+2OH-可得C(OH-)=0.05mol/0.5L=0.1mol/L所以PH=13
考点:理解盖斯定律,并能运用盖斯定律进行有关反应焓变的简单计算。了解化学平衡常数的含义,能利用化学平衡常数进行相关计算。理解外界条件(浓度、温度、压强、催化剂等)对反应速率和化学平衡的影响,认识并能用相关理论解释其一般规律。 了解原电池和电解池的工作原理,能写出电极反应和电池反应方程式。
点评:本题考查热化学方程式的书写及盖斯定律的应用、化学平衡常数的求算、利用影响化学反应速率与化学平衡的因素控制化学反应的进行,电化学方程式的书写有简单计算,考查对知识理解能力与综合运用能力。
本题所属考点:【常见的化学电源】
本题难易程度:【困难】
If we are bound to forgive an enemy,we are not bound to trust him. 敌人可恕不可信。