微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 将Zn棒和Cu棒用导线连接后,放入某电解质溶液中,构成如下图所示装置。试回答下列问题:
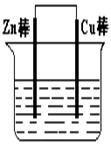
(1)若电解质溶液为稀硫酸,则Zn棒为原电池的 极,可观察到Cu棒的所产生现象是 ,写出该电极反应式: 。
(2)若电解质为硫酸铜溶液,则Cu棒上发生 反应,Zn棒上发生反应的电极反应式为: & #160; 。
填空题 将Zn棒和Cu棒用导线连接后,放入某电解质溶液中,构成如下图所示装置。试回答下列问题:

(1)若电解质溶液为稀硫酸,则Zn棒为原电池的 极,可观察到Cu棒的所产生现象是 &# 91EXAM.org160;,写出该电极反应式: 。
(2)若电解质为硫酸铜溶液,则Cu棒上发生 反应,Zn棒上发生反应的电极反应式为: 。
本题答案:(10分)(1)负极(2分)有气泡生成(或有气体放出)(2分
本题解析:
试题分析:(1)原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应。锌比铜活泼,所以锌失去电子,做负极。铜是正极,溶液中的氢离子在正极得到电子,生成氢气,电极反应式是2H++2e-=H2↑,所以实验现象是有气泡生成(或有气体放出)。
(2)若电解质为硫酸铜溶液,则溶液中的铜离子在正极得到电子,发生还原反应。而锌仍然是负极,失去电子,电极反应式是Zn-2e-=Zn2+。
考点:考查原电池的有关判断以及电极反应式的书写
点评:该题是中等难度的试题,也是高考中的常见题型,属于基础性试题的考查。试题贴近教材,基础性强,有利于激发学生的学习兴趣和学习积极性。该题的关键是明确原电池的工作原理,然后结合题意灵活运用即可。有利于培养学生的逻辑推理能力和规范的答题能力。
本题所属考点:【原电池原理】
本题难易程度:【一般】
He that thinks too much of his virtues bids others think of his vice. 念念不忘自己长处的人,使别人想起他的缺点。