微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。
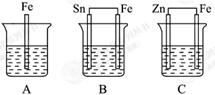
(1) A中反应的离子方程式为 。
(2)B中Sn极的电极反应式为 。Sn极附近溶液的c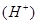 (填 “变大”“变小”或“不变”)。
(填 “变大”“变小”或“不变”)。
(3)C中被腐蚀的金属是 ; ,总反应的化学方程式为
,比较A、B、C中铁被腐蚀的速率,由快到慢的顺序为 (填序号)。
填空题 A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。

(1) A中反应的离子方程式为 。
(2)B中Sn极的电极反应式为 。Sn极附近溶液的c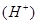 (填 “变大”“变小”或“不变”)。
(填 “变大”“变小”或“不变”)。
(3)C中被腐蚀的金属是来源:91考试网 91ExAm.org ,总反应的化学方程式为
,比较A、B、C中铁被腐蚀的速率,由快到慢的顺序为 (填序号)。
本题答案:(12分,每空2分)(1)Fe + 2H+= Fe + H2
本题解析:
试题分析:(1)装置A中铁直接与稀硫酸发生置换反应,反应的离子方程式是Fe + 2H+= Fe + H2↑。
(2)装置B中铁的金属性强于Sn的,则铁是负极,Sn是正极,溶液中的氢离子在正极得到电子,电极反应式是2H+ + 2e-=H2↑,所以正极周围溶液中氢离子浓度变小。
(3)装置C中锌的金属性强于铁的,锌失去电子,做负极,被腐蚀。铁是正极,被保护,总的方程式是Zn + H2SO4= ZnSO4 + H2↑。根据以上分析可知,A、B、C中铁被腐蚀的速率,由快到慢的顺序为B>A>C。
考点:考查原电池的有关应用、金属的腐蚀与防护
点评:该题是基础性试题的考查,也是高考中的重要考点。主要是考查学生对原电池原理以及金属腐蚀与防护的熟悉了解程度,意在培养学生分析、归纳和总结问题的能力。该题的关键是明确原电池的工作原理,然后结合题意灵活运用即可。
本题所属考点:【原电池原理】
本题难易程度:【一般】
There is no rule without an exception. 有规则必有例外。