|
|
|
(共14分)氨是一种重要的化工产品,是氮肥工业、有机合成工业以【原电池原理】
2016-12-25 01:37:17
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 (共14分)氨是一种重要的化工产品,是氮肥工业、有机合成工业以及制造硝酸、铵盐和纯碱等的原料。
(1)以氨为燃料可以设计制造氨燃料电池,因产物无污染,在很多领域得到广泛应用。若电极材料均为惰性电极,KOH溶液作电解质溶液,则该电池负极电极反应式为 。
(2)在一定温度下,在固定体积的密闭容器中进行可逆反应:N2+3H2 2NH3。该可逆反应达到平衡的标志是________________。 2NH3。该可逆反应达到平衡的标志是________________。
A.3v(H2)正=2v(NH3)逆
B.单位时间生成m mol N2的同时消耗3m mol H2
C.容器内的总压强不再随时间而变化
D.混合气体的密度不再随时间变化
| E.a molN≡N键断裂的同时,有6amolN—H键断裂
F.N2、H2、NH3的分子数之比为1∶3∶2
(3)某化学研究性学习小组模拟工业合成氨的反应。在容积固定为2L的密闭容器内充入1molN2和3molH2,加入合适催化剂(体积可以忽略不计)后在一定温度压强下开始反应,并用压力计监测容器内压强的变化如下:
反应时间/min
| 0
| 5
| 10
| 15
| 20
| 25
| 30
| 压强/MPa
| 16.80
| 14.78
| 13.86
| 13.27
| 12.85
| 12.60
| 12.60
|
则从反应开始到25min时,以N2表示的平均反应速率= ;该温度下平衡常数K= ;
(4)以CO2与NH3为原料合成尿素[化学式为CO(NH2)2]的主要反应如下,已知:
①2NH3(g)+CO2(g) ="=" NH2CO2 NH4(s) △H=" —l59.5" kJ/mol
②NH2CO2NH4(s)  CO(NH2)2(s)+H2O(g) △H="+116.5" kJ/mol CO(NH2)2(s)+H2O(g) △H="+116.5" kJ/mol
③H2O(1) ="=" H2O(g) △H=+44.0kJ/mol
写出CO2与NH3合成尿素和液态水的热化学反应方程式 ;
对于上述反应②在密闭容器中将 过量NH2CO2NH4固体于300K下分解,平衡时P[H2O(g)]为a Pa,若反应温度不变,将体系的体积增加50%,则P[H2O(g)]的取值范围是_________________(用含a的式子表示)。(分压=总压×物质的量分数)
填空题 (共14分)氨是一种重要的化工产品,是氮肥工业、有机合成工业以及制造硝酸、铵盐和纯碱等的原料。
(1)以氨为燃料可以设计制造氨燃料电池,因产物无污染,在很多领域得到广泛应用。若电极材料均为惰性电极,KOH溶液作电解质溶液,则该电池负极电极反应式为 。
(2)在一定温度下,在固定体积的密闭容器中进行可逆反应:N2+3H2 2NH3。该可逆反应达到平衡的标志是________________。 2NH3。该可逆反应达到平衡的标志是________________。
A.3v(H2)正=2v(NH3)逆
B.单位时间生成m mol N2的同时消耗3m mol H2
C.容器内的总压强不再随时间而变化
D.混合气体的密度不再随时间变化
|
E.a molN≡N键断裂的同时,有6amolN—H键断裂
F.N2、H2、NH3的分子数之比为1∶3∶2
(3)某化学研究性学习小组模拟工业合成氨的反应。在容积固定为2L的密闭容器内充入1molN2和3molH2,加入合适催化剂(体积可以忽略不计)后在一定温度压强下开始反应,并用压力计监测容器内压强的变化如下:
反应时间/min
| 0
| 5
| 10
| 15
| 20
| 25
| 30
|
压强/MPa
| 16.80
| 14.78
| 13.86
| 13.27
| 12.85
| 12.60
| 12.60
|
则从反应开始到25min时,以N2表示的平均反应速率=
;该温度下平衡常数K=
;
(4)以CO2与NH3为原料合成尿素[化学式为CO(NH2)2]的主要反应如下,已知:
①2NH3(g)+CO2(g) ="=" NH2CO2 NH4(s) △H=" —l59.5" kJ/mol
②NH2CO2NH4(s)

CO(NH2)2(s)+H2O(g) △H="+116.5" kJ/mol
③H2O(1) ="=" H2O(g) &#
91ExAm.org160; △H=+44.0kJ/mol
写出CO2与NH3合成尿素和液态水的热化学反应方程式
;
对于上述反应②在密闭容器中将过量NH2CO2NH4固体于300K下分解,平衡时P[H2O(g)]为a Pa,若反应温度不变,将体系的体积增加50%,则P[H2O(g)]的取值范围是_________________(用含a的式子表示)。(分压=总压×物质的量分数)
本题答案:(1)2NH3—6e—+6OH—=N2+6H2O
本题解析:
试题分析:(1)原电池中负极失去电子,发生氧化反应,则该原电池中氨气在负极通入,由于电解质溶液显碱性,则负极电极反应式为2NH3—6e—+6OH—=N2+6H2O。
(2)A、3v(H2)正=2v(NH3)逆不能满足反应速率之比是相应的化学计量数之比,反应没有达到平衡状态,应该是2v(H2)正=3v(NH3)逆,A错误;B、单位时间生成m mol N2的同时消耗3m mol H2,说明正逆反应速率相等,反应达到平衡状态,B正确;C、该反应是体积缩小的反应,反应过程中压强是变化的量,压强不变,说明正逆反应速率相等,达到了平衡状态,故C正确;D、密度是混合气体的质量与容器容积的比值,质量与容积均是不变的,即密度始终不变,所以混合气体的密度不再随时间变化不能说明反应达到平衡状态,D错误;E、a molN≡N键断裂的同时,有6amolN—H键断裂,说明正逆反应速率相等,反应达到平衡状态,E正确;F、各组分的物质的量之比,无法判断各组分的物质的量是否变化,无法判断是否达到平衡状态,故F错误;答案选BCE。
(3) N2 + 3H2

2NH3
起始浓度(mol/L) 0.5 1.5 0
转化浓度(mol/L) x 3x 2x
平衡浓度(mol/L)0.5-x 1.5-3x 2x
根据表中数据可知
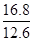
=

解得x=0.25
所以从反应开始到25min时,以N2表示的平均反应速率=0.25mol/L÷25min=0.01 mol/(L.min)
该温度下的平衡常数K=
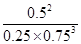
=2.37( mol/L)-2
(4)①2NH3(g)+CO2(g)
本题所属考点:【原电池原理】
本题难易程度:【一般】
Give credit where credit is due. 有功则赏。
 CO(NH2)2(s)+H2O(g) △H="+116.5" kJ/mol
CO(NH2)2(s)+H2O(g) △H="+116.5" kJ/mol CO(NH2)2(s)+H2O(g) △H="+116.5" kJ/mol
CO(NH2)2(s)+H2O(g) △H="+116.5" kJ/mol 2NH3
2NH3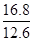 =
=
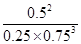 =2.37( mol/L)-2
=2.37( mol/L)-2