|
|
|
(15分)(化学与技术)某硫酸厂以含有SO2的尾气、氨气等为原料?【原电池原理】
2016-12-25 01:39:28
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 (15分)(化学与技术)某硫酸厂以含有SO2的尾气、氨气等为原料,合成有重要应用价值的硫化钙、硫酸钾、亚硫酸铵等物质。合成路线如下:
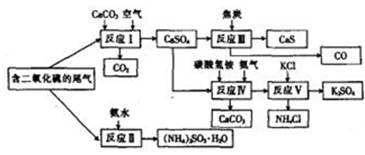
(1)写出反应Ⅲ的化学方程式: 。
(2)下列有关说法正确的是 (填字母)
A.反应Ⅰ中需鼓入足量空气,以保证二氧化硫充分氧化生成硫酸钙
B.反应Ⅱ和反应Ⅲ的基本反应类型相同
C.反应Ⅳ需控制在60---70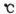 ,目的之一是减少碳酸氢铵的分解 ,目的之一是减少碳酸氢铵的分解
D.反应Ⅴ中的副产物氯化铵可用作氮肥
| (3)(NH4)2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,形成共生系统。写出二氧 91ExAM.org化氮与亚硫酸铵反应的化学方程式: 。
(4)很多硫酸厂为回收利用SO2,直接用氨水吸收法处理尾气。
① 用15.0 mL 2.0 mol/L氨水吸收标准状况下448 mL SO2,吸收液中的溶质为
。
② 某同学用酸性KMnO4溶液滴定上述吸收液,当达到滴定终点时,消耗KMnO4溶液25.00 mL,则酸性KMnO4,溶液中c(KMnO4) = 。
(5)氨气用途广泛,可以直接用于燃料电池,下图是用氨水作原料的燃料电池的工作原理。
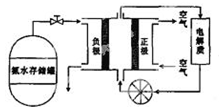
氨气燃料电池的电解质溶液最好选择 (填“酸性”、“碱性”或“中性”)溶液,氨气燃料电池的反应是氨气与氧气生成一种常见的无毒气体和水,该电池总反应的化学方程式是 ,负极的电极反应式是
。
填空题 (15分)(化学与技术)某硫酸厂以含有SO2的尾气、氨气等为原料,合成有重要应用价值的硫化钙、硫酸钾、亚硫酸铵等物质。合成路线如下:

(1)写出反应Ⅲ的化学方程式: 。
(2)下列有关说法正确的是 (填字母)
A.反应Ⅰ中需鼓入足量空气,以保证二氧化硫充分氧化生成硫酸钙
B.反应Ⅱ和反应Ⅲ的基本反应类型相同
C.反应Ⅳ需控制在60---70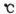 ,目的之一是减少碳酸氢铵的分解 ,目的之一是减少碳酸氢铵的分解
D.反应Ⅴ中的副产物氯化铵可用作氮肥
|
(3)(NH4)2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,形成共生系统。写出二氧化氮与亚硫酸铵反应的化学方程式:
; 。
(4)很多硫酸厂为回收利用SO2,直接用氨水吸收法处理尾气。
① 用15.0 mL 2.0 mol/L氨水吸收标准状况下448 mL SO2,吸收液中的溶质为
。
② 某同学用酸性KMnO4溶液滴定上述吸收液,当达到滴定终点时,消耗KMnO4溶液25.00 mL,则酸性KMnO4,溶液中c(KMnO4) =
。
(5)氨气用途广泛,可以直接用于燃料电池,下图是用氨水作原料的燃料电池的工作原理。

氨气燃料电池的电解质溶液最好选择
(填“酸性”、“碱性”或“中性”)溶液,氨气燃料电池的反应是氨气与氧气生成一种常见的无毒气体和水,该电池总反应的化学方程式是
,负极的电极反应式是
。
本题答案:(1)CaSO4+4C
由流程图可知反应III是硫酸钙与焦炭在高温条件下反应生成CaS和CO,化学方程式为CaSO4+4C<img onload='if(this.width>600)makesmallpic(this,600,1800);' src=)
CaS+4CO↑;
(2)A、反应I中鼓入足量的空气目的就是使二氧化硫充分被氧化为硫酸钙,正确;B、反应II是二氧化硫与氨水的化合反应,而反应III不属于基本反应类型,二者的基本反应类型不同,错误;C、反应Ⅳ需控制在60~70℃,防止碳酸氢铵在温度过高时分解得不到需要的目标产物,正确;D、反应V的产物之一是氯化铵,含有N元素,可用作氮肥,正确,答案选ACD;
(3)二氧化氮与亚硫酸铵反应,二氧化氮具有强氧化性能氧化亚硫酸铵反应,生成硫酸铵,本身被还原为氮气,由原子守恒可知化学方程式为4(NH4)2SO3+2NO2=4(NH4)2SO4+N2;
(4)①标准状况下448 mL SO2的物质的量是0.02mol,氨气的物质的量是0.015L×2.0mol/L=0.03mol,二氧化硫与氨气的物质的量之比1/2<2/3<1,所以吸收液中的溶质既有(NH4)2SO3,也有(NH4)HSO3;
②用KMnO4溶液去滴定吸收液,实质是高锰酸钾与二氧化硫反应,根据得失电子守恒,0.02mol二氧化硫失去电子的物质的量是0.02mol×2=0.04mol,高锰酸钾中Mn元素化合价降低为+2价,则0.025L×5×c=0.04,所以高锰酸钾的浓度c=0.32mol/L;
(5)氨气燃料电池中的电解质溶液最好选择碱性溶液,因为该反应的实质是氨气与氧气反应,所以尽量减少氨气在溶液中的溶解度,氨气溶于水显碱性,所以氨气在碱性溶液中的溶解度最小,所以选择碱性溶液;氨气与氧气生成一种常见的无毒气体和水,则无毒气体是氮气,所以总反应的方程式为4NH3+3O2=2N2+6H2O,负极发生氧化反应,从总反应方程式中可看出,N元素的化合价升高,所以氨气发生氧化反应,结合电解质溶液,则负极的反应式为2 NH3-6e-+6OH-=N2+6 H2O.
考点:考查对反应流程的分析,二氧化硫的化学性质,氧化还原反应的计算,原电池反应原理的应用
本题所属考点:【原电池原理】
本题难易程度:【一般】
Gather ye rosebuds while ye may. 有花堪折直须折,莫待花无空折枝.

