|
|
|
已知:95℃时,KW=1.0×10-12.在该温度下,测得0.1mol·L-1Na2A【盐类水解的原理】
2016-12-25 15:58:00
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
选择题 已知:95℃时,KW=1.0×10-12.在该温度下,测得0.1mol·L-1Na2A溶液pH=6,则下列说法正确的是
A.H2A在水溶液中的电离方程式为:H2A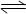 H++HA-,HA- H++HA-,HA-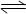 H++A2- H++A2-
B.(NH4)2A溶液中存在离子浓度关系:c(NH4+)>c(A2-)>c(H+)>c(OH-)
C.0.0lmol·L-l的H2A溶液pH=2
D.等体积等浓度的盐酸与H2A溶液分别与5.6g Zn反应,H2A溶液产生的H2多
|
选择题 已知:95℃时,KW=1.0×10-12.在该温度下,测得0.1mol·L-1Na2A溶液pH=6,则下列说法正确的是
A.H2A在水溶液中的电离方程式为:H2A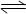 H++HA-,HA- H++HA-,HA-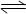 H++A2- H++A2-
B.(NH4)2A溶液中存在离子浓度关系:c(NH4+)>c(A2-)>c(H+)>c(OH-)
C.0.0lmol·L-l的H2A溶液pH=2
D.等体积等浓度的盐酸与H2A溶液分别与5.6g Zn反应,H2A溶液产生的H2多
|
本题答案:B
本题解析:
试题分析:95℃时,KW=1.0×10-12.在该温度下中性溶液的pH=6。在该温度下,测得0.1mol·L-1Na2A溶液pH=6,证明该盐是强酸强碱盐,H2A是强酸。A.H2A是强酸,在溶液中完全电
来源:91 考试网离,所以电离方程式为:H2A="=" 2H++ A2-;错误;B.根据物料守恒可得:c(NH4+)>c(A2-);(NH4)2A是强酸弱碱盐,弱碱阳离子NH4+在溶液中发生水解反应消耗水电离产生的OH-,使溶液显酸性,所以c(H+)>c(OH-);但是盐的水解作用是微弱的,在溶液中盐的电离产生的离子浓度远大于水的电离,所以c(A2-)>c(H+)。故溶液中存在离子浓度关系:c(NH4+)>c(A2-)>c(H+)>c(OH-),正确;C.由于H2A是强酸,完全电离,所以0.0lmol·L-l的H2A溶液c(H+)=0.02mol/L,pH<2,错误;D.等体积等浓度的盐酸与H2A溶液中由于后者的n(H+)多,若酸过量,则分别与5.6g Zn反应,溶液产生的H2一样多,若酸相对来说不足量,则H2A溶液产生的H2多,错误。
考点:考查电解质的强弱、溶液的酸碱性、离子浓度的大小比较的知识。
本题所属考点:【盐类水解的原理】
本题难易程度:【一般】
The good is the enemy of the best. 过得去是精益求精的敌人。