|
|
|
25C时,用浓度为0.1000 mol/L的NaOH溶液滴定20. 00 mL 0 .1000 m【盐类水解的原理】
2016-12-25 15:58:28
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
选择题 25C时,用浓度为0.1000 mol/L的NaOH溶液滴定20. 00 mL 0 .1000 mol·L-1的
CH3COOH.。滴定曲线如图所示。下列分析错误的是
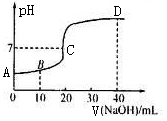
A.C点的溶液:c(CH3COO一)+c(CH.3COOH)>c(Na+)
B.B点的溶液c (CH3COO一)>c(Na+)>c(H+)> c(OH-)
C.A点的纵坐标值为l
D.D点溶液2c(CH3 COOH)十c(H+) =c(OH—)—c(CH3COO—)
|
选择题 25C时,用浓度为0.1000 mol/L的NaOH溶液滴定20. 00 mL 0 .1000 mol·L-1的
CH3COOH.。滴定曲线如图所示。下列分析错误的是

A.C点的溶液:c(CH3COO一)+c(CH.3COOH)>c(Na+)
B. B点的溶液c (CH3COO一)>c(Na+)>c(H+)> c(OH-)
C.A点的纵坐标值为l
D.D点溶液2c(CH3COOH)十c(H+) =c(OH—)—c(CH3COO—)
|
本题答案:C
本题解析:
试题分析:A、C点时溶液为中性,所以c(CH3COO一)= c(Na+),所以c(CH3COO一)+c(CH.3COO)H>c(Na+),正确;B、B点表示醋酸与氢氧化钠未完全反应,此时为醋酸与醋酸钠的混合液,溶液显酸性,所以c (CH3COO一)>c(Na+)>c(H+)> c(OH-),正确;C、A点表示醋酸溶液的pH,醋酸是弱酸,所以浓度是0.1000mol/L的醋酸溶液的pH大于1,错误;D、D点表示等浓度的氢氧化钠与醋酸钠的混合液,所以有c(Na+)=2(c(CH3COO一)+c(CH.3COOH)),根据电荷守恒可得c(CH3COO一)+ c(OH—)= c(Na+)+ c(H+),两式联立可得2c(CH3COOH)十c(H+) =c(OH—)—c(CH3COO—),正确,答案选C。
考点:考查对电解质溶液的判断,离子浓度的比较,守恒规律的应用
本题所属考点:【盐类水解的原理】
本题难易程度:【一般】
There are no faults in a thing we want badly. 我们非常想要的东西总是没有缺点的。