|
|
|
常温下,在0.1mol/L的碳酸钠溶液中,下列离子浓度的关系式正确的【盐类水解的原理】
2016-12-25 16:02:20
来源:91考试网
作者:www.91exam.org 【 大 中 小】
选择题 常温下,在0.1mol/L的碳酸钠溶液中,下列离子浓度的关系式正确的是
A.2c(H2CO3)+c(HCO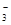 )+c(H+) = c(OH-) )+c(H+) = c(OH-)
B.c(Na+) = c(HCO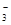 )+c(H2CO3)+ 2c(CO )+c(H2CO3)+ 2c(CO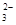 ) )
C.c(Na+)>c(H+)>c(OH-)>c(CO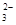 ) )
D.c(Na+)+c(H+) = c(HCO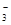 )+c(OH-)+ 2c(CO )+c(OH-)+ 2c(CO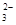 ) )
|
本题答案:AD
本题解析:
试题分析:碳酸钠首先会电离出钠离子和碳酸根离子,而碳酸根离子会发生水解生成碳酸氢根离子和氢氧根离子。而碳酸根离子与水会发生水解,生成碳酸和氢氧根离子,同时水也能电离出氢离子和氢氧根离子,据物料守恒可知A选项是正确的。B选项。在溶液中钠的原子个数是碳原子个数的两倍,据原子个数守恒可知,B选项是错误的。C选项,碳酸钠属于强碱弱酸盐,因此容易显碱性,故,氢氧根离子浓度大于氢离子浓度,所以C选项是错误的。D选项,据电荷数守恒可知D选项是正确的。
考点:电解质溶液
本题所属考点:【盐类水解的原理】
本题难易程度:【一般】
One good turn deserves another. 应以德报德。