|
|
|
下列对于25 ℃时pH为12的氨水,叙述正确的是A.加入一定量pH【盐类水解的原理】
2016-12-25 16:11:31
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
选择题 下列对于25 ℃时pH为12的氨水,叙述正确的是
A.加入一定量pH=2的醋酸,混合后所得的溶液中:c(CH3COO-)+c(OH-)=c(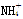 )+c(H+) )+c(H+)
B.向其中加入一定量的水,NH3·H2O的电离平衡正移,溶液中所有离子浓度均减小
C.与等体积、pH=2的盐酸混合后所得的溶液中:c(Cl-) >c(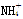 )> c(H+)>c(OH-) )> c(H+)>c(OH-)
D.c(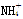 )+c(NH3·H2O)=1.0×10-12 mol·L-1 )+c(NH3·H2O)=1.0×10-12 mol·L-1
|
选择题 下列对于25 ℃时pH为12的氨水,叙述正确的是
A.加入一定量pH=2的醋酸,混合后所得的溶液中:c(CH3COO-)+c(OH-)=c(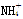 )+c(H+) )+c(H+)
B.向其中加入一定量的水,NH3·H2O的电离平衡正移,溶液中所有离子浓度均减小
C.与等体积、pH=2的盐酸混合后所得的溶液中:c(Cl-) >c(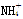 )> c(H+)>c(OH-) )> c(H+)>c(OH-)
D.c(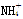 )+c(NH3·H2O)=1.0×10-12 mol·L-1 )+c(NH3·H2O)=1.0×10-12 mol·L-1
|
本题答案:A
本题解析:
试题解析:由电荷守恒可知:c(CH3COO-)+c(OH-)=c(NH4+)+c(H+),故A正确;加水,NH3·H2O的电离平衡正移,铵根、氢氧根浓度减小,但氢离子浓度增大,故B错误;25℃,pH=12的氨水中,由水电离出c(OH-)=c(H+)=1.0×10-12 mol/L;氨水过量,反应后溶液中溶质为NH4C1和剩余的NH3·H2O,溶液呈碱性,应有c(NH4+)>c(Cl-)>c(OH-)>c(H+),故C错误;一水合氨是弱电解质,PH等于12时,一水合氨浓度远大于10-2 mol·L-1,根据物料守恒知,c(
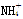
)+c(NH3·H2O)>1.0×10-12 mol·L-1,故D错误。
考点:电解质溶液、盐类水解
本题所属考点:【盐类水解的原理】
本题难易程度:【一般】
Time is the greatest teacher. 时间就是良师.
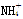 )+c(NH3·H2O)>1.0×10-12 mol·L-1,故D错误。
)+c(NH3·H2O)>1.0×10-12 mol·L-1,故D错误。