微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 (16分)盐酸、醋酸和碳酸是化学实验和研究中常用的几种酸。
已知室温下:Ka(CH3COOH)=1.7×10-5 mol·L-1 ;H2CO3的电离常数Ka1=4.2×10-7mol·L-1 、Ka2=5.6×10-11mol·L-1
(1)①请用离子方程式解释碳酸氢钠水溶液显碱性的原因 ; 。
②常温下,物质的量浓度相同的下列四种溶液:
a、碳酸钠溶液 b、醋酸钠溶液 c、氢氧化钠溶液 d、氢氧化钡溶液。
其PH由大到小的顺序是: (填序号)。
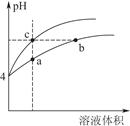
(2)某温度下,pH均为4的盐酸和醋酸溶液分别加水稀释,其pH随溶液体积变化的曲线图中a、b、c三点对应的溶液中水的电离程度由大到小的顺序是 ;该醋酸溶液稀释过程中,下列各量一定变小的是 。
a.c(H+) b.c(OH-)
c.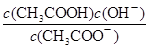 d.
d.
(3)以0.10 mol·L-1NaOH为标准液,测定某盐酸的浓度。取20.00 mL待测盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用NaOH标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
实验编号
| 氢氧化钠溶液的浓度
(mol·L-1)
| 滴定完成时,氢氧化钠溶液滴入的体积(mL)
| 待测盐酸的体积(mL)
|
1
| 0.10
| 24.12
| 20.00
|
2
| 0.10
| 23. 88
| 20.00
|
3
| 0.10
| 24.00
| 20.00
|
①滴定达到终点的标志是___________________________________________。
②根据上述数据,可计算出该盐酸的浓度约为__________________。
(4)在t℃时,某NaOH稀溶液中c(H+)=10-amol·L-1,c(OH-)=10-b mol·L-1,已知a+b=12,则:
①该温度下水的离子积常数Kw= mol2·L-2。
②在该温度下,将100mL0.1 mol·L-1的稀H2SO4与100mL0.4 mol·L-1的NaOH溶液混合后,溶液的pH= 。
填空题 (16分)盐酸、醋酸和碳酸是化学实验和研究中常用的几种酸。
已知室温下:Ka(CH3COOH)=1.7×10-5 mol·L-1 ;H2CO3的电离常数Ka1=4.2×10-7mol·L-1 、Ka2=5.6×10-11mol·L-1
(1)①请用离子方程式解释碳酸氢钠水溶液显碱性的原因 。
②常温下,物质的量浓度相同的下列四种溶液:
a、碳酸钠溶液 b、醋酸钠溶液 c、氢氧化钠溶液 d、氢氧化钡溶液。
其PH由大到小的顺序是: (填序号)。
(2)某温度下,pH均为4的盐酸和醋酸溶液分别加水稀释,其pH随溶液体积变化的曲线图中a、b、c三点对应的溶液中水的电离程度由大到小的顺序是 ;该醋酸溶液稀释过程中,下列各量一定变小的是 。

a.c(H+) b.c(OH-)
c.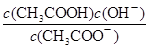 d.
d.
(3)以0.10 mol·L-1NaOH为标准液,测定某盐酸的浓度。取20.00 mL待测盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用NaOH标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
实验编号
| 氢氧化钠溶液的浓度
(mol·L-1)
| 滴定完成时,氢氧化钠溶液滴入的体积(mL)
| 待测盐酸的体积(mL)
|
1
| 0.10
| 24.12
| 20.00
|
2
| 0.10
| 23. 88
| 20.00
|
3
| 0.10
| 24.00
| 20.00
|
①滴定达到终点的标志是___________________________________________。
②根据上述数据,可计算出该盐酸的浓度约为__________________。
(4)在t℃时,某NaOH稀溶液中c(H+)=10-amol·L-1,c(OH-)=10-b mol·L-1,已知a+b=12,则:
①该温度下水的离子积常数Kw= mol2·L-2。
②在该温度下,将100mL0.1 mol·L-1的稀H2SO4与100mL0.4 mol·L-1的NaOH溶液混合后,溶液的pH= 。
本题答案:(1)①HCO3— + H2O HCO3—既能水解也能电离,水解方程式为HCO3— + H2O <img onload='if(this.width>600)makesmallpic(this,600,1800);' src=) H2CO3 + OH—,水解呈碱性,电离方程式为HCO3—
H2CO3 + OH—,水解呈碱性,电离方程式为HCO3— CO32-+ H+电离呈酸性,电离程度小于水解程度所以溶液呈碱性;氢氧化钠、氢氧化钡为强碱,、氢氧化钡中OH—的浓度比氢氧化钠大,所以PH氢氧化钡大于氢氧化钠;碳酸钠、醋酸钠为强碱弱酸盐,碳酸根水解程度大于醋酸根离子水解,所以碳酸钠溶液的PH大于醋酸钠;(2)对于酸溶液,PH越小对水的电离的抑制作用越大,所以水的电离程度由大到小的顺序是b=c>a;醋酸溶液加水稀释,c(H+)减小,KW不变,所以c(OH-)增大;
CO32-+ H+电离呈酸性,电离程度小于水解程度所以溶液呈碱性;氢氧化钠、氢氧化钡为强碱,、氢氧化钡中OH—的浓度比氢氧化钠大,所以PH氢氧化钡大于氢氧化钠;碳酸钠、醋酸钠为强碱弱酸盐,碳酸根水解程度大于醋酸根离子水解,所以碳酸钠溶液的PH大于醋酸钠;(2)对于酸溶液,PH越小对水的电离的抑制作用越大,所以水的电离程度由大到小的顺序是b=c>a;醋酸溶液加水稀释,c(H+)减小,KW不变,所以c(OH-)增大;
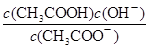

 ,所以
,所以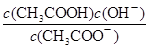 不变;
不变;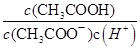 为常数,醋酸溶液加水稀释,
为常数,醋酸溶液加水稀释, 减小,所以
减小,所以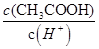 变小;(3)酚酞在盐酸中呈无色,滴加氢氧化钠溶液,溶液PH增大,滴入最后一滴NaOH溶液,溶液由无色恰好变成浅红色且半分钟内不褪色,达到滴定终点;三次滴定,消耗的氢氧化钠溶液的体积平均为24mL,根据
变小;(3)酚酞在盐酸中呈无色,滴加氢氧化钠溶液,溶液PH增大,滴入最后一滴NaOH溶液,溶液由无色恰好变成浅红色且半分钟内不褪色,达到滴定终点;三次滴定,消耗的氢氧化钠溶液的体积平均为24mL,根据 ;可得盐酸的浓度为0.12 mol·L-1;(4)①Kw=
;可得盐酸的浓度为0.12 mol·L-1;(4)①Kw= =
=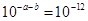 ;②溶液混合后呈碱性,
;②溶液混合后呈碱性,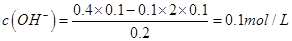 ,
,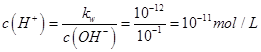 ;所以PH=11.
;所以PH=11.
考点:本题考查盐的水解 、弱电解质电离、中和滴定。
本题所属考点:【盐类水解的原理】
本题难易程度:【困难】
It is better to please a fool than to anget him. 若惹蠢人生气,不如使他欢喜。