|
|
|
常温下已知两种一元弱酸HX和HY,如果向NaX溶液中通CO2气体,只能【盐类水解的原理】
2016-12-25 16:21:23
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
选择题 ;常温下已知两种一元弱酸HX和HY,如果向NaX溶液中通CO2气体,只能生成HX和NaHCO3;往NaY溶液中通入CO2则生成HY和Na2CO3。有关叙述正确的是:( )
A.三种酸的电离常数Ki(HX)> Ki(HY)> Ki(H2CO3)
B.结合H+的能力:Y->CO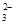 >X->HCO >X->HCO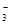
C.溶液碱性:NaX>Na2CO3>NaY>NaHCO3
D.NaX溶液中通入足量CO2后的离子浓度:C(Na+)>c(HCO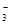 )>C(X-)>c(OH-)>c(H+) )>C(X-)>c(OH-)>c(H+)
|
选择题 常温下已知两种一元弱酸HX和HY,如果向NaX溶液中通CO2气体,只能生成HX和NaHCO3;往NaY溶液中通入CO2则生成HY和Na2CO3。有关叙述正确的是:( )
A.三种酸的电离常数Ki(HX)> Ki(HY)> Ki(H2CO3)
B.结合H+的能力:Y->CO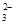 >X->HCO >X->HCO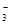
C.溶液碱性:NaX>Na2CO3>NaY>NaHCO3
D.NaX溶液中通入足量CO2后的离子浓度:C(Na+)>c(HCO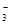 )>C(X-)>c(OH-)>c(H+) )>C(X-)>c(OH-)>c(H+)
|
本题答案:B
本题解析:
试题分析:向NaX溶液中通CO2气体,只能生成HX和NaHCO3;则酸性H2CO3>HX> HCO
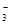
;往NaY溶液中通入CO2则生成HY和Na2CO3。则酸性H2CO3 > HCO
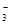
>HY;故酸性:则酸性H2CO3>HX> HCO
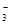
>HY; A.酸性越强,则在相同的温度下,酸的电离平衡常数就越大,所以三种酸的电离常数Ki(H2CO3) > Ki(HX)> Ki(HY) ,错误;B.酸越弱,则酸根离子结合H+的能力就越强,由于酸性:H2CO3>HX> HCO
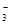
>HY;结合H+的能力:Y->CO
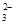
>X->HCO
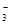
,正确;C.弱酸的酸性越弱,则其形成的强碱的盐溶液水解程度就越大,溶液碱性就越强,所以溶液的碱性:: NaY>Na2CO3> NaX> NaHCO3,错误;D.NaX溶液中通入足量CO2后的离子浓度:会产生HX和NaHCO3;溶液显酸性,离子浓度:C(Na+)>c(HCO
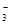
)>C(X-)>c(H+)>c(OH-),错误。
考点:考查弱酸的电离、盐的水解、溶液中离子浓度的大小比较的知识。
本题所属考点:【盐类水解的原理】
本题难易程度:【困难】
Can man be free if woman is a slave? 妇女当牛做马,男子焉能自由?
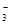 ;往NaY溶液中通入CO2则生成HY和Na2CO3。则酸性H2CO3 > HCO
;往NaY溶液中通入CO2则生成HY和Na2CO3。则酸性H2CO3 > HCO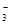 >HY;故酸性:则酸性H2CO3>HX> HCO
>HY;故酸性:则酸性H2CO3>HX> HCO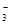 >HY; A.酸性越强,则在相同的温度下,酸的电离平衡常数就越大,所以三种酸的电离常数Ki(H2CO3) > Ki(HX)> Ki(HY) ,错误;B.酸越弱,则酸根离子结合H+的能力就越强,由于酸性:H2CO3>HX> HCO
>HY; A.酸性越强,则在相同的温度下,酸的电离平衡常数就越大,所以三种酸的电离常数Ki(H2CO3) > Ki(HX)> Ki(HY) ,错误;B.酸越弱,则酸根离子结合H+的能力就越强,由于酸性:H2CO3>HX> HCO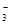 >HY;结合H+的能力:Y->CO
>HY;结合H+的能力:Y->CO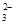 >X->HCO
>X->HCO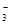 ,正确;C.弱酸的酸性越弱,则其形成的强碱的盐溶液水解程度就越大,溶液碱性就越强,所以溶液的碱性:: NaY>Na2CO3> NaX> NaHCO3,错误;D.NaX溶液中通入足量CO2后的离子浓度:会产生HX和NaHCO3;溶液显酸性,离子浓度:C(Na+)>c(HCO
,正确;C.弱酸的酸性越弱,则其形成的强碱的盐溶液水解程度就越大,溶液碱性就越强,所以溶液的碱性:: NaY>Na2CO3> NaX> NaHCO3,错误;D.NaX溶液中通入足量CO2后的离子浓度:会产生HX和NaHCO3;溶液显酸性,离子浓度:C(Na+)>c(HCO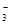 )>C(X-)>c(H+)>c(OH-),错误。
)>C(X-)>c(H+)>c(OH-),错误。