|
|
|
下列有关说法正确的是A.将0.2mol/L的NH3·H2O与0.1mol/L的H【盐类水解的原理】
2016-12-25 16:26:48
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
选择题 下列有关说法正确的是
A.将0.2mol/L的NH3·H2O与0.1mol/L的HCl溶液等体积混合后pH >7,则c(Cl-)>c(NH4+)>c(OH-)>c (H+)
B.已知MgCO3的Ksp=6.82×10-6,则所有含有固体MgCO3的溶液中,都有C(Mg2+)=C(CO32-),且c(Mg2+)·c(CO32-)==6.82×10-6 mol?L—1
C.0.1mol/LNa2CO3与0.1mol/LNaHCO3溶液等体积混合: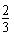 c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
D.用惰性电极电解Na2SO4溶液,阳阴两极产物的物质的量之比为2:1
|
选择题 下列有关说法正确的是
A.将0.2mol/L的NH3·H2O与0.1mol/L的HCl溶液等体积混合后pH >7,则c(Cl-)>c(NH4+)>c(OH-)>c(H+)
B.已知MgCO3的Ksp=6.82×10-6,则所有含有固体MgCO3的溶液中,都有C(Mg2+)=C(CO32-),且c(Mg2+)·c(CO32-)==6.82×10-6 mol?L—1
C.0.1mol/LNa2CO3与0.1mol/LNaHCO3溶液等体积混合: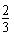 c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
D.用惰性电极电解Na2SO4溶液,阳阴两极产物的物质的量之比为2:1
|
本题答案:C
本题解析:
试题分析:A.将0.2mol/L的NH3·H2O与0.1mol/L的HCl溶液等体积混合后生成氯化铵,其中氨水过量,且二者的浓度相等。溶液的pH >7,说明氨水的电离程度大于铵根的水解程度,则c(NH4+)>c(Cl-)>c(OH-)>c(H+),A错误;B.已知MgCO3的Ksp=6.82×10-6,但所有含有固体MgCO3的溶液中,不一定有C(Mg2+)=C(CO32-),且c(Mg2+)·c(CO32-)==6.82×10-6 mol?L—1,B错误;C.0.1mol/LNa2CO3与0.1mol/LNaHCO3溶液等体积混合后根据物料守恒可知:
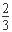
c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3),C正确;D.用惰性电极电解Na2SO4溶液,相当于是电解水,阳阴两极产物分别是氧气和氢气,则二者物质的量之比为1:2,D错误,答案选C。
考点:考查溶液中离子浓度比较、溶度积常数应用以及电解原理的应用等
本题所属考点:【盐类水解的原理】
本题难易程度:【一般】
Many words will not fill a bushel. 空言无补于事。
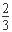 c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3),C正确;D.用惰性电极电解Na2SO4溶液,相当于是电解水,阳阴两极产物分别是氧气和氢气,则二者物质的量之比为1:2,D错误,答案选C。
c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3),C正确;D.用惰性电极电解Na2SO4溶液,相当于是电解水,阳阴两极产物分别是氧气和氢气,则二者物质的量之比为1:2,D错误,答案选C。