|
|
|
(12分,每空2分)(1)常温下,将0.2 mol/L HCl溶液与0.2 mol【盐类水解的原理】
2016-12-25 16:27:34
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 (12分,每空2分)(1)常温下,将0.2 mol/L HCl溶液与0.2 mol/L氨水等体积混合(忽略混合后溶液体积的变化),测得混合后溶液的pH=6,试回答以下问题:
(1)混合后溶液呈酸性的原因是(用离子方程式回答) 。
(2)混合后溶液中由水电离出的c(OH-)为 & #160;
(3)常温下,将0.2 mol·L-1的盐酸与 0.2mol·L-1的氨水混合,若所得的混合溶液中的pH=7,下列关系正确的是
A.[Cl-]>[NH4+]> [H+] > [OH-]
B.[NH4+]>[Cl-]>[OH-]>[H+]
C.[Cl-]=[NH4+]>[H+]=[OH-]
D.[NH4+]>[Cl-]>[H+]>[OH-]
| (4)由电离常数可知酸性强弱: CH3COOH>H2CO3>HCO3-,则浓度相同的下列溶液碱性由强到弱顺序为: (填序号)
①CH3COONa ②NaHCO3 ③Na2CO3
(5)将氯化铁溶液蒸干、灼烧,最后得到的固体是 。
(6)Cu(OH)2(s)  Cu2+(aq)+2OH-(aq),在常温下Ksp( Cu(OH)2)=2×10-20。在常温下如果要生成Cu(OH)2沉淀,需要向0.02 mol?L-1的CuSO4溶液中加入NaOH溶液,调整pH最小到 。 Cu2+(aq)+2OH-(aq),在常温下Ksp( Cu(OH)2)=2×10-20。在常温下如果要生成Cu(OH)2沉淀,需要向0.02 mol?L-1的CuSO4溶液中加入NaOH溶液,调整pH最小到 。
填空题 (12分,每空2分)(1)常温下,将0.2 mol/L HCl溶液与0.2 mol/L氨水等体积混合(忽略混合后溶液体积的变化),测得混合后溶液的pH=6,试回答以下问题:
(1)混合后溶液呈酸性的原因是(用离子方程式回答) 。
(2)混合后溶液中由水电离 出的c(OH-)为
(3)常温下,将0.2 mol·L-1的盐酸与 0.2mol·L-1的氨水混合,若所得的混合溶液中的pH=7,下列关系正确的是
A.[Cl-]>[NH4+]> [H+] > [OH-]
B.[NH4+]>[Cl-]>[OH-]>[H+]
C.[Cl-]=[NH4+]>[H+]=[OH-]
D.[NH4+]>[Cl-]>[H+]>[OH-]
|
(4)由电离常数可知酸性强弱: CH3COOH>H2CO3>HCO3-,则浓度相同的下列溶液碱性由强到弱顺序为:
(填序号)
①CH3COONa ②NaHCO3 ③Na2CO3
(5)将氯化铁溶液蒸干、灼烧,最后得到的固体是
。(6)Cu(OH)2(s)

Cu2+(aq)+2OH-(aq),在常温下Ksp( Cu(OH)2)=2×10-20。在常温下如果要生成Cu(OH)2沉淀,需要向0.02 mol?L-1的CuSO4溶液中加入NaOH溶液,调整pH最小到
。
本题答案:(1)①NH4+ + H2O
常温下,将0.2 mol/L HCl溶液与0.2 mol/L氨水等体积混合,两者恰好完全反应生成NH4Cl,NH4Cl在水中完全电离产生:NH4+、Cl-,NH4+会水解:NH4+ + H2O <img onload='if(this.width>600)makesmallpic(this,600,1800);' src=)
NH3·H2O + H+,使溶液中c(H+)>c(OH-),溶液呈酸性;水解促进了水的电离,则水电离出的c(OH-)= c(H+)=10-6mol/L;常温下,将0.2 mol·L-1的盐酸与 0.2mol·L-1的氨水混合,若所得的混合溶液中的pH=7,可知溶液为NH4Cl和少量NH3·H2O的混合液,主体离子为NH4+、Cl-,次要微弱离子为H+、OH-,且存在电荷守恒:c(NH4+)+ c(H+)= c(Cl-)+ c(OH-),溶液呈中性即c(OH-)= c(H+),则c(NH4+)= c(Cl-),故C项正确;因为酸性强弱:CH3COOH>H2CO3>HCO3-,则水解程度大小关系为:CO32—> HCO3-> CH3COO—,故①CH3COONa ② NaHCO3 ③Na2CO3的碱性强弱为:③> ② >①;氯化铁溶液中存在水解平衡:FeCl3+3H2O

Fe(OH)3+3HCl,加热水解平衡正向移动,且HCl挥发,故将氯化铁溶液蒸干则生成Fe(OH)3,灼烧2Fe(OH)3==Fe2O3+3H2O,故最后得到的固体是Fe2O3;在常温下Ksp(Cu(OH)2)=2×10-20可知向0.02 mol?L-1的CuSO4溶液中加入NaOH溶液,得:
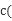
O
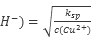
=10-9 mol/L,则溶液pH=5。
考点:弱电解质电离、水解平衡、难溶电解质溶解平衡。
本题所属考点:【盐类水解的原理】
本题难易程度:【困难】
If you want people to think well of you,do not speak well of yourself. 要想人们对你有好感,就不要说自己的好话。
 Cu2+(aq)+2OH-(aq),在常温下Ksp( Cu(OH)2)=2×10-20。在常温下如果要生成Cu(OH)2沉淀,需要向0.02 mol?L-1的CuSO4溶液中加入NaOH溶液,调整pH最小到 。
Cu2+(aq)+2OH-(aq),在常温下Ksp( Cu(OH)2)=2×10-20。在常温下如果要生成Cu(OH)2沉淀,需要向0.02 mol?L-1的CuSO4溶液中加入NaOH溶液,调整pH最小到 。  Cu2+(aq)+2OH-(aq),在常温下Ksp( Cu(OH)2)=2×10-20。在常温下如果要生成Cu(OH)2沉淀,需要向0.02 mol?L-1的CuSO4溶液中加入NaOH溶液,调整pH最小到 。
Cu2+(aq)+2OH-(aq),在常温下Ksp( Cu(OH)2)=2×10-20。在常温下如果要生成Cu(OH)2沉淀,需要向0.02 mol?L-1的CuSO4溶液中加入NaOH溶液,调整pH最小到 。 Fe(OH)3+3HCl,加热水解平衡正向移动,且HCl挥发,故将氯化铁溶液蒸干则生成Fe(OH)3,灼烧2Fe(OH)3==Fe2O3+3H2O,故最后得到的固体是Fe2O3;在常温下Ksp(Cu(OH)2)=2×10-20可知向0.02 mol?L-1的CuSO4溶液中加入NaOH溶液,得:
Fe(OH)3+3HCl,加热水解平衡正向移动,且HCl挥发,故将氯化铁溶液蒸干则生成Fe(OH)3,灼烧2Fe(OH)3==Fe2O3+3H2O,故最后得到的固体是Fe2O3;在常温下Ksp(Cu(OH)2)=2×10-20可知向0.02 mol?L-1的CuSO4溶液中加入NaOH溶液,得: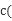 O
O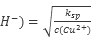 =10-9 mol/L,则溶液pH=5。
=10-9 mol/L,则溶液pH=5。