微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 (10分)
(1)以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐。电池反应正极电极反应式为_______;放电时,CO32-移向电池的______(填“正”或“负”)极。
(2)碳氢化合物完全燃烧生成CO2和H2O。常温常压下,空气中的C来源:91考试网 www.91exAm.orgO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5 mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3 HCO3-+H+的平衡常数K1=_____________。(已知:10-5.60=2.5×10-6)
HCO3-+H+的平衡常数K1=_____________。(已知:10-5.60=2.5×10-6)
(3)常温下,0.1 mol·L-1NaHCO3溶液的pH大于8,则溶液c(H2CO3)______c(CO32-)(填“>”、“=”或“<”),原因是__________(用离子方程式和必要的文字说明)。
填空题 (10分 )
(1)以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐。电池反应正极电极反应式为_______;放电时,CO32-移向电池的______(填“正”或“负”)极。
(2)碳氢化合物完全燃烧生成CO2和H2O。常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5 mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3 HCO3-+H+的平衡常数K1=_____________。(已知:10-5.60=2.5×10-6)
HCO3-+H+的平衡常数K1=_____________。(已知:10-5.60=2.5×10-6)
(3)常温下,0.1 mol·L-1NaHCO3溶液的pH大于8,则溶液c(H2CO3)______c(CO32-)(填“>”、“=”或“<”),原因是__________(用离子方程式和必要的文字说明)。
本题答案:(1) O2+4e-+2CO2=2CO32-;负;(2)4.
本题解析:
试题分析:(1)在该燃料电池中,正极上是O2得到电子与CO2结合形成CO32-,电极反应式是:O2+4e-+2CO2 =2CO32-电池放电时,根据同种电荷相互排斥,异种电荷相互吸引的原则,CO32-移向正电荷较多的电池的负极;
(2)H2CO3 HCO3-+H+的平衡常数K1=
HCO3-+H+的平衡常数K1=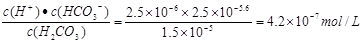 ;
;
(3)在常温下,在NaHCO3溶液中存在HCO3-的电离作用HCO3- CO32-+H+和HCO3-的水解作用HCO3-+H2O
CO32-+H+和HCO3-的水解作用HCO3-+H2O H2CO3 +OH-,电离使溶液显酸性,水解使溶液显碱性,由于0.1mol/L的NaHCO3溶液pH大于8,说明其水解作用大于电离作用,则溶液c(H2CO3)> c(CO32-)。
H2CO3 +OH-,电离使溶液显酸性,水解使溶液显碱性,由于0.1mol/L的NaHCO3溶液pH大于8,说明其水解作用大于电离作用,则溶液c(H2CO3)> c(CO32-)。
考点:考查燃料电池的各种原理、电离平衡常数的应用及盐的水解和电离的应用的知识。
本题所属考点:【盐类水解的原理】
本题难易程度:【一般】
A friend to all is a friend to none. 对一切人都是朋友,对哪一个也不是朋友.