|
|
|
下列溶液中,说法正确的是A.NaHCO3溶液中可以大量存在NO<im【盐类水解的原理】
2016-12-25 16:53:08
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
选择题 下列溶液中,说法正确的是
A.NaHCO3溶液中可以大量存在NO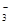 、AlO 、AlO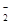 、K+、S2-等离子 、K+、S2-等离子
B.室温下0.1 mol/L的NaOH溶液与pH=1的某酸HA等体积混合后,溶液中C(Na+)≥C(A-)
C.1 mo l/L的醋酸溶液加水稀释时,溶液中所有离子浓度均减小
D.t℃时,水的离子积常数为Kw,则[c(OH-)]2=Kw的水溶液一定呈中性
|
选择题 下列溶液中,说法正确的是
A.NaHCO3溶液中可以大量存在NO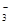 、AlO 、AlO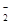 、K+、S2-等离子 、K+、S2-等离子
B.室温下0.1 mol/L的NaOH溶液与pH=1的某酸HA等体积混合后,溶液中C(Na+)≥C(A-)
C.1 mol/L的醋酸溶液加水稀释时,溶液中所有离子浓度均减小
D.t℃时,水的离子积常数为Kw,则[c(OH-)]2=Kw的水溶液一定呈中性
|
本题答案:D
本题解析:
试题分析:A、碳酸氢钠溶液中存在电离碳酸氢根离子,与偏铝酸根离子发生反应生成碳酸根离子和氢氧化铝沉淀,不可能大量存在,错误;B、若HA为强酸,则C(Na+) =C(A-);若HA为弱酸,则酸的浓度大于氢氧化钠的浓度,则等体积混合,酸过量,所得溶液为HA与NaA的混合液,溶液呈酸性,所以C(Na+) <C(A-),错误;C、醋酸加水稀释,醋酸的电离平衡正向移动,但醋酸根离子、氢离子浓度仍减小,但温度不变,水的离子积常数不变,则氢氧根离子浓度增大,错误;D、t℃时,水的离子积常数为Kw= c(OH-)×c(H+)=[c(OH-)]2,则c(OH-)=c(H+),所以溶液呈中性,正确,答案选D。
考点:考查离子大量共存的判断,酸碱 混合的判断,溶液稀释离子浓度变化的判断,水离子积常数的应用
本题所属考点:【盐类水解的原理】
本题难易程度:【困难】
Better a witty fool than a foolish wit. 宁要机智的傻子,不要愚蠢的机智人。