微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 (本题共13分)
氨气是重要的化工原料,工业上利用N2和H2合成NH3,方程式如下:N2 +3H2 2NH3
2NH3
29.已知NH3难溶于CCl4,则下列装置中,不能用于吸收氨气的是
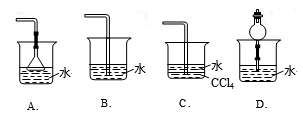
30.某温度下,在一体积恒定为10L的密闭容器内模拟合成氨反应。若开始时充入:0.1mol N2、0.1mol H2和0.2mol NH3,则此时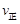
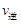 (填“>”或“<”或“=”,已知该温度下,平衡常数K值为
(填“>”或“<”或“=”,已知该温度下,平衡常数K值为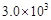 )。
)。
若要增大反应速率,且平衡向正反应方向移动,下列措施中可行的是 (填字母代号)。
A.压缩容器体积 B.适当升高温度
C.通入适量氮气 D.加适量催化剂
31.能说明上述反应达到平衡状态的是
A.2υ (H2)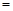 3υ(NH3)
3υ(NH3)
B.混合气体的密度不再改变
C.混合气体的平均相对分子质量不再改变
D.单位时间内生成n mol N2的同时生成2n mol NH3
32.氨气溶于水所得溶液在加水稀释的过程中(本小题填“增大”或“减小”或“不变”),NH来源:91考试网 www.91eXam.org3·H2O的电离程度 ,电离平衡常数 ,溶液的pH值 。
33.氨气与酸反应得到铵盐,某(NH4)2SO4水溶液的pH=5,原因是溶液中存在平衡 (用离子方程式表示),该稀溶液中水的电离度约为 。
填空题 (本题共13分)
氨气是重要的化工原料,工业上利用N2和H2合成NH3,方程式如下:N2 +3H2 2NH3
2NH3
29.已知NH3难溶于CCl4,则下列装置中,不能用于吸收氨气的是
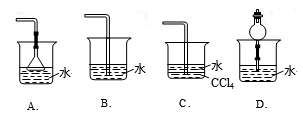
30.某温度下,在一体积恒定为10L的密闭容器内模拟合成氨反应。若开始时充入:0.1mol N2、0.1mol H2和0.2mol NH3,则此时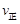
 (填“>”或“<”或“=”,已知该温度下,平衡常数K值为
(填“>”或“<”或“=”,已知该温度下,平衡常数K值为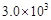 )。
)。
若要增大反应速率,且平衡向正反应方向移动,下列措施中可行的是 (填字母代号)。
A.压缩容器体积 B.适当升高温度
C.通入适量氮气 D.加适量催化剂
31.能说明上述反应达到平衡状态的是
A.2υ (H2)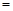 3υ(NH3)
3υ(NH3)
B.混合气体的密度不再改变
C.混合气体的平均相对分子质量不再改变
D.单位时间内生成n mol N2的同时生成2n mol NH3
32.氨气溶于水所得溶液在加水稀释的过程中(本小题填“增大”或“减小”或“不变”),NH3·H2O的电离程度 ,电离平衡常数 ,溶液的pH值 。
33.氨气与酸反应得到铵盐,某(NH4)2SO4水溶液的pH=5,原因是溶液中存在平衡 (用离子方程式表示),该稀溶液中水的电离度约为 。
本题答案:(共13分)29.B(1分) ;30.< (
本题解析:
试题分析:29.氨气极容易溶于水,为了使氨气被充分吸收,同时又防止倒吸现象的发生,通常在导气管的末端安装一个倒扣的漏斗或一个干燥管,当氨气溶解是导气管内气体的压强减小时,水进入漏斗或干燥管,因为它们的容积较大,当较大量的水进入该装置时,烧杯内的水面下降,漏斗过干燥管内的水又流回到烧杯内,从而防止了倒吸的发生;也可以将导气管伸入到氨气不能溶解、密度比水大的有机物若CCl4中,气体从导气管内逸出,在上升的过程中遇水,发生反应、溶解,同时也防止了倒吸的发生,而B中导气管直接伸入水中会引起倒吸现象的发生,故选项是B。
30.在反应开始时,c(N2)=0.01mol/L,c(H2)=0.01mol/L,c(NH3)=0.02mol/L,Qc=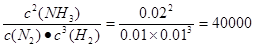 >K=
>K= 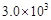 ,说明平衡逆向移动,
,说明平衡逆向移动,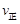 <
<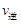 ; A.压缩容器体积物质的浓度增大,体系的压强增大,正反应速率加快,由于正反应是气体体积减小的反应,所以增大压强,平衡正向移动,正确;B.适当升高温度单位体积内活化分子数增加,化学反应速率加快,由于该反应的正反应是放热反应,升高温度,平衡向吸热的逆反应方向移动,错误;C.通入适量氮气,即增大了反应物的浓度正反应速率加快,增大反应物浓度,平衡向正反应方向移动,正确;D.加适量催化剂,正反应和逆反应的速率都加快,由于催化剂对正反应和逆反应速率影响相同,所以加入催化剂,平衡不发生移动,错误;选项A、C。
; A.压缩容器体积物质的浓度增大,体系的压强增大,正反应速率加快,由于正反应是气体体积减小的反应,所以增大压强,平衡正向移动,正确;B.适当升高温度单位体积内活化分子数增加,化学反应速率加快,由于该反应的正反应是放热反应,升高温度,平衡向吸热的逆反应方向移动,错误;C.通入适量氮气,即增大了反应物的浓度正反应速率加快,增大反应物浓度,平衡向正反应方向移动,正确;D.加适量催化剂,正反应和逆反应的速率都加快,由于催化剂对正反应和逆反应速率影响相同,所以加入催化剂,平衡不发生移动,错误;选项A、C。
31. A.根据方程式中氢气与氨气的系数关系可知,在任何时刻都存在2υ (H2)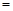 3υ(NH3),因此不能作为判断平衡的标志,错误;B.由于反应是在体积恒定不变的容器内进行的反应,反应前后气体物质的质量不变,所以在任何时刻都存在混合气体的密度不变,故不能作为判断平衡的标志,错误;C.该反应的正反应是气体体积减小的反应,若反应为达到平衡状态,则气体的物质的量就会发生变化,而气体的质量也不变,则混合气体的平均相对分子质量就必然发生改变,现在气体的相对分子质量不变,说明气体的物质的量不变,反应处于平衡状态,正确;D.单位时间内生成n mol N2,就会同时消耗2nmol的NH3,此时还同时生成2n mol NH3,则氨气的物质的量不变,反应处于平衡状态,正确。
3υ(NH3),因此不能作为判断平衡的标志,错误;B.由于反应是在体积恒定不变的容器内进行的反应,反应前后气体物质的质量不变,所以在任何时刻都存在混合气体的密度不变,故不能作为判断平衡的标志,错误;C.该反应的正反应是气体体积减小的反应,若反应为达到平衡状态,则气体的物质的量就会发生变化,而气体的质量也不变,则混合气体的平均相对分子质量就必然发生改变,现在气体的相对分子质量不变,说明气体的物质的量不变,反应处于平衡状态,正确;D.单位时间内生成n mol N2,就会同时消耗2nmol的NH3,此时还同时生成2n mol NH3,则氨气的物质的量不变,反应处于平衡状态,正确。
32.氨气溶于水得到氨水,在氨水中存在电离平衡:NH3 · H2O NH4++OH-,在所得溶液在加水稀释的过程中,由于离子浓度减小的倍数大于电解质分子极性的倍数,所以电离平衡正向移动,即NH3 · H2O的电离程度增大,而电离平衡常数至于温度有关,温度不变,则电离平衡常数就不变,加水对溶液中的离子起稀释作用,是离子浓度减小,平衡正向移动是离子浓度又增大,但是平衡移动的趋势是微弱的,所以总的来说,溶液中c(OH-)浓度减小,所以溶液的pH值减小;
NH4++OH-,在所得溶液在加水稀释的过程中,由于离子浓度减小的倍数大于电解质分子极性的倍数,所以电离平衡正向移动,即NH3 · H2O的电离程度增大,而电离平衡常数至于温度有关,温度不变,则电离平衡常数就不变,加水对溶液中的离子起稀释作用,是离子浓度减小,平衡正向移动是离子浓度又增大,但是平衡移动的趋势是微弱的,所以总的来说,溶液中c(OH-)浓度减小,所以溶液的pH值减小;
33.某(NH4)2SO4水溶液的pH=5,是因为在NH4+在溶液发生水解反应NH4++ H2O  NH3 · H2O +H+,消耗了水电离产生的OH-,破坏了水的电离平衡,当最终达到平衡时溶液中c(H+)>c(OH-),所以溶液显酸性。溶液的pH="5," c(H+)=10-5mol/L,由于 水的浓度是c(H2O)="(1000g÷18g/mol)" ÷1L=(1000/18)mol/L,则该稀溶液中水的电离度约为(10-5mol/L÷(18/1000)mol/L)×100%=1.8×10-5% 。
NH3 · H2O +H+,消耗了水电离产生的OH-,破坏了水的电离平衡,当最终达到平衡时溶液中c(H+)>c(OH-),所以溶液显酸性。溶液的pH="5," c(H+)=10-5mol/L,由于 水的浓度是c(H2O)="(1000g÷18g/mol)" ÷1L=(1000/18)mol/L,则该稀溶液中水的电离度约为(10-5mol/L÷(18/1000)mol/L)×100%=1.8×10-5% 。
考点:考查防止倒吸的装置、化学平衡常数的计算与反应进行的方向的判断、影响化学反应速率和平衡移动的因素、平衡状态的判断、溶液稀释对弱电解质电离平衡的影响、盐的水解及水电离度的计算。
本题所属考点:【盐类水解的原理】
本题难易程度:【一般】
Money is a bottomless sea, in which honour, conscience, and truth may be drowned. 金钱是深不可测的海洋,能淹没廉耻,良心和是非感.