微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
选择题 25℃时,向20 mL 0.2 mol/L H2A(某二元弱酸)溶液中滴加0.2 m 91eXaM.orgol/L NaOH溶液,有关微粒的物质的量变化如下图(其中I代表H2A,II代表HA-,III代表A2-)?根据图示判断,下列说法中正确的是
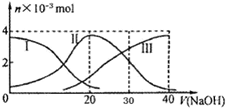
A.当V(NaOH)=20mL时,所得溶液中:c(OH-)> c(H+)
B.当V(NaOH)=30mL时,所得溶液中:2c(H+) + c(HA-)+ 3c(H2A) = c(A2-) + 2 c(OH-)
C.当V(NaOH)=40mL时,所得溶液中:c(Na+)> c(A2-) >c(H+)> c(HA-) >c(OH-)
D.在NaHA溶液中:c(OH-)+2c(A2-) = c(H+)+2c(H2A)
选择题 25℃时,向20 mL 0.2 mol/L H2A(某二元弱酸)溶液中滴加0.2 mol/L NaOH溶液,有关微粒的物质的 91Exam.org量变化如下图(其中I代表H2A,II代表HA-,III代表A2-)?根据图示判断,下列说法中正确的是

A.当V(NaOH)=20mL时,所得溶液中:c(OH-)> c(H+)
B.当V(NaOH)=30mL时,所得溶液中:2c(H+) + c(HA-)+ 3c(H2A) = c(A2-) + 2 c(OH-)
C.当V(NaOH)=40mL时,所得溶液中:c(Na+)> c(A2-) >c(H+)> c(HA-) >c(OH-)
D.在NaHA溶液中:c(OH-)+2c(A2-) = c(H+)+2c(H2A)
本题答案:B
本题解析:
试题分析:A.当V(NaOH)=20mL时,发生反应:NaOH+H2A=NaHA+H2O。所得溶液是NaHA。由于HA-在溶液中存在电离作用和水解作用,电离产生H+使溶液显酸性,水解消耗H+,使溶液显碱性。由于此时溶液中c(H2A)< c(A2-),说明水解作用很弱,电离占优势,故(OH-)<c(H+),错误。B.当V(NaOH)=30mL时,所得溶液是NaHA、Na2A等浓度的混合溶液。根据图像可知c(HA-)< c(A2-),说明c(HA-)的电离程度大于c(A2-)的水解程度。溶液显酸性。根据物料守恒可得:2c(Na+)=3c(A2-)+ 3c(HA-)+3c(H2A)。根据电荷守恒可得c(H+)+ c(Na+)=c(OH-)+2 c(A2-)+c(HA-)。将第二个式子扩大2倍,与第一个式子相减,整理可得2c(H+) + c(HA-)+ 3c(H2A) = c(A2-) + 2 c(OH-),正确;C.当V(NaOH)=40mL时,酸碱恰好完全中和,产生Na2A。由于该盐是强碱弱酸盐,A2-发生水解反应而消耗,水电离产生的H+被消耗,最终当溶液中的水达到电离平衡时,c(OH-)> c(H+)。由于溶液中除了A2-、HA-水解产生OH-外,还存在水电离产生的OH-。所以c(OH-)> c(HA-) 。故溶液中离子浓度大小关系正确的是所得溶液中:c(Na+)> c(A2-) > c(OH-)> c(HA-)>c(H+),错误。
考点:考查酸碱发生中和反应时溶液中离子浓度大小比较的关系的知识。
本题所属考点:【盐类水解的原理】
本题难易程度:【困难】
Trust thyself only, and another shall not betray thee. 不信他人信自己,别人不会出卖你。